早教吧作业答案频道 -->化学-->
CO2和CH4均为温室气体,若得以综合利用,对于温室气体的整治具有重大意义.(1)已知:CO2(g)+CH4(g)═2CO(g)+2H2(g)△H═+247.3kJ/molCH4(g)═C(s)+2H2(g)△H═+75KJ/mol反应2CO(g)
题目详情
CO2和CH4均为温室气体,若得以综合利用,对于温室气体的整治具有重大意义.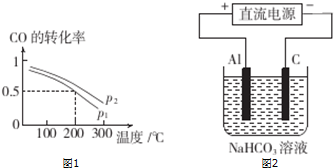
(1)已知:CO2(g)+CH4(g)═2CO(g)+2H2(g)△H═+247.3kJ/mol
CH4(g)═C(s)+2H2 (g)△H═+75KJ/mol
反应2CO(g)⇌C(s)+CO2(g)在一定条件下能自发进行的原因是___
(2)合成甲醇的主要反应是CO(g)+2H2(g)═CH3OH(g).压强为P1时,向体积为2L的密闭容器中充人b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图1所示.请回答:
①该反应属于___(填“吸”或“放”)热反应;
P1___P2(填“>”、“<”或“=”).200℃时,该反应的平衡常数K=___(用含b的代数式表示).
②若200℃时,上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为___.
(3)以渗透于多孔基质的惰性导电物质材料为电极,用35%~50%KOH为电解液,甲烷和空气为原料,构成碱性燃料电池,该电池负极的电极反应式为___
(4)以甲烷燃料电池做电源,用如图2所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,用离子方程式表示沉淀产生的原因是___.
(5)已知25℃时,Al(OH)3的Ksp=8.0×10 -33.若使某铝盐溶液中的Al3+降至1.0×10-6 mol.L-l时,则需调节溶液的pH至___ (已知lg5=0.7).

(1)已知:CO2(g)+CH4(g)═2CO(g)+2H2(g)△H═+247.3kJ/mol
CH4(g)═C(s)+2H2 (g)△H═+75KJ/mol
反应2CO(g)⇌C(s)+CO2(g)在一定条件下能自发进行的原因是___
(2)合成甲醇的主要反应是CO(g)+2H2(g)═CH3OH(g).压强为P1时,向体积为2L的密闭容器中充人b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图1所示.请回答:
①该反应属于___(填“吸”或“放”)热反应;
P1___P2(填“>”、“<”或“=”).200℃时,该反应的平衡常数K=___(用含b的代数式表示).
②若200℃时,上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为___.
(3)以渗透于多孔基质的惰性导电物质材料为电极,用35%~50%KOH为电解液,甲烷和空气为原料,构成碱性燃料电池,该电池负极的电极反应式为___
(4)以甲烷燃料电池做电源,用如图2所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,用离子方程式表示沉淀产生的原因是___.
(5)已知25℃时,Al(OH)3的Ksp=8.0×10 -33.若使某铝盐溶液中的Al3+降至1.0×10-6 mol.L-l时,则需调节溶液的pH至___ (已知lg5=0.7).
▼优质解答
答案和解析
(1)已知:①CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=+247.3kJ•mol-1
②CH4(g)⇌C(s)+2H2(g)△H=+75kJ•mol-1,根据盖斯定很,将②-①得反应2CO(g)⇌C(s)+CO2(g)△H=-172.3kJ•mol-1,△H<0,而该反应△S<0,所以该反应在温度较低的条件下可以自发进行,
故答案为:该反应中△H<0,△S<0,在温度较低的条件下可以自发进行;
(2)①根据图可知,温度越高,CO的转化率越小,所以该反应的正反应为放热反应,根据图相同温度时P2的CO的转化率大于P1,而该反应为气体体积减小的反应,压强越大,CO的转化率越高,所以P12,200℃时,CO的转化率为0.5,所以平衡时CO、H2、CH3OH的浓度分别为0.25bmol/L、0.5bmol/L、0.25bmol/L,所以平衡常数K=
=
,
故答案为:放;<;
;
②若200℃时,上述反应经过tmin达到平衡,氢气转化的浓度为0.5bmol/L,所以该时间段内氢气的平均反应速率为
mol/(L•min)=
mol/(L•min),
故答案为:
mol/(L•min);
(3)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,负极的电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;
(4)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)根据Ksp[Al( OH)3]=c(Al3+)•c3(OH-)可知,c(OH-)=
=2×10-9,所以c(H+)=5×10-6,pH值为6-lg5=5.3,
故答案为:5.3.
②CH4(g)⇌C(s)+2H2(g)△H=+75kJ•mol-1,根据盖斯定很,将②-①得反应2CO(g)⇌C(s)+CO2(g)△H=-172.3kJ•mol-1,△H<0,而该反应△S<0,所以该反应在温度较低的条件下可以自发进行,
故答案为:该反应中△H<0,△S<0,在温度较低的条件下可以自发进行;
(2)①根据图可知,温度越高,CO的转化率越小,所以该反应的正反应为放热反应,根据图相同温度时P2的CO的转化率大于P1,而该反应为气体体积减小的反应,压强越大,CO的转化率越高,所以P1
| 0.25b |
| 0.25b×(0.5b)2 |
| 4 |
| b2 |
故答案为:放;<;
| 4 |
| b2 |
②若200℃时,上述反应经过tmin达到平衡,氢气转化的浓度为0.5bmol/L,所以该时间段内氢气的平均反应速率为
| 0.5b |
| t |
| b |
| 2t |
故答案为:
| b |
| 2t |
(3)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,负极的电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;
(4)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)根据Ksp[Al( OH)3]=c(Al3+)•c3(OH-)可知,c(OH-)=
| 3 |
| ||
故答案为:5.3.
看了 CO2和CH4均为温室气体,...的网友还看了以下:
公式:样品中的蛋白质含量(μg/g鲜重)={[查得的蛋白质含量(μg)] ×稀释倍数}/[样品鲜重 2020-05-17 …
用滑轮组加速提升重物,机械效率如何计算用滑轮组加速提升重物,绳子端施加的力为F,重物重为G,上升距 2020-06-02 …
如图,一体重为G的工人通过定滑轮拉着放在水平地面上的重物A,所用的力为F.若重物A所受重力为GA, 2020-06-23 …
如图所示,动滑轮重为1N,拉力F为5N,则重物G和弹簧秤读数为()A.G为4N,弹簧测力计读数为5 2020-06-30 …
一件行李重为G,被绳OA和OB吊在空中,OA绳和OB绳的拉力分别为F1、F2,如图所示,则[]A.F 2020-11-01 …
一人站在体重计上称体重,保持立正姿式时称得体重为G,当其缓慢地将一条腿平直伸出台面,体重计指针稳定后 2020-11-10 …
某同学在家中自测体重为G,之后把家用体重计放到电梯中再测体重,在他从九楼一直下到一楼的过程(中间不停 2020-11-14 …
某同学在家中自测体重为G,之后把家用体重计放到电梯中再测体重,在他从九楼一直下到一楼的过程(中间不停 2020-11-14 …
一根长为L的细绳能承受的最大拉力为F,现把重为G(G=F)的重物拴在绳的中点一根轻质细绳能承受的最大 2020-11-28 …
(2014•吴江市模拟)(1)在图甲中,质量为0.4kg的均匀球体保持静止,请画出该球所受重力G的示 2021-01-15 …