早教吧作业答案频道 -->化学-->
一种工业制备SrCl•6H2O的生产流程如下:已知:①M(SrCl2•6H2O)=267g/mol;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质
题目详情
一种工业制备SrCl•6H2O的生产 流程如下:
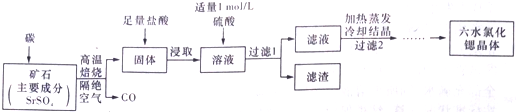
已知:①M(SrCl2•6H2O)=267g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质.
(1)隔绝空气高温焙烧,若2mol SrSO4中只有S被还原,转移了16mol电子.写出该反应的化学方程式:___.
(2)过滤2后还需进行的两步操作是___、___.
(3)加入硫酸的目的是___;为了提高原料的利用率,滤液中Sr2+的浓度应不高于___ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO31.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是___.
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为___(保留4位有效数字).

已知:①M(SrCl2•6H2O)=267g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质.
(1)隔绝空气高温焙烧,若2mol SrSO4中只有S被还原,转移了16mol电子.写出该反应的化学方程式:___.
(2)过滤2后还需进行的两步操作是___、___.
(3)加入硫酸的目的是___;为了提高原料的利用率,滤液中Sr2+的浓度应不高于___ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO31.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是___.
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为___(保留4位有效数字).
▼优质解答
答案和解析
SrSO4和碳隔绝空气高温焙烧生成CO、固体,固体加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,过滤除去,滤液中含SrCl2等,最后蒸发浓缩、冷却结晶、洗涤、干燥得到SrCl2•6H2O.
(1)SrSO4和碳隔绝空气高温焙烧,C发生氧化反应生成CO,设S元素在还原产物中化合价为x,根据电子转移守恒,则6mol×(6-x)=16mol,解得x=-2,故还原产物为CrS,反应方程式为:SrSO4+4C
SrS+4CO↑,
故答案为:SrSO4+4C
SrS+4CO↑;
(2)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,
故答案为:洗涤、干燥;
(3)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,
由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=0.03mol/L,
故答案为:除去溶液中Ba2+杂质;0.03;
(4)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,
故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,
1.000g产品中SrCl2•6H2O的物质的量为:n(SrCl2•6H2O)=
×n(Ag+)=3.5×10-3mol,
1.000g产品中SrCl2•6H2O的质量为:m(SrCl2•6H2O)=3.5×10-3mol×267 g/mol=0.9345g,
所以产品纯度为:
×100%=93.45%,
故答案为:93.45%.
(1)SrSO4和碳隔绝空气高温焙烧,C发生氧化反应生成CO,设S元素在还原产物中化合价为x,根据电子转移守恒,则6mol×(6-x)=16mol,解得x=-2,故还原产物为CrS,反应方程式为:SrSO4+4C
| ||
故答案为:SrSO4+4C
| ||
(2)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,
故答案为:洗涤、干燥;
(3)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,
由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=
| 1.1×10-10 |
| 1×10-5 |
| 3.3×10-7 |
| 1.1×10-5 |
故答案为:除去溶液中Ba2+杂质;0.03;
(4)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,
故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,
1.000g产品中SrCl2•6H2O的物质的量为:n(SrCl2•6H2O)=
| 1 |
| 2 |
1.000g产品中SrCl2•6H2O的质量为:m(SrCl2•6H2O)=3.5×10-3mol×267 g/mol=0.9345g,
所以产品纯度为:
| 0.9435g |
| 1g |
故答案为:93.45%.
看了 一种工业制备SrCl•6H2...的网友还看了以下:
由a^2,2-a,4组成的集合A .A 中含有3个元素.则实数a的取值是..由a^2,2-a,4组 2020-04-05 …
(2009•武威)X、Y、Z三种物质属于常见的酸、碱、盐,它们在溶液中有如下转化关系(1)W+Cu 2020-04-11 …
能溶于硝酸的沉淀fe(OH)3 ,BaCO3,BaSO4,Cu(OH)3 2020-05-16 …
Fe2(SO4)3+Ba(OH)2-------BaSO4↓+Fe(OH)3↓ 2020-05-17 …
设一个总体含有3个可能元素,取值分别为1,2,3。从该总体中采取重复抽样方法抽取样本量为2的所有可 2020-05-21 …
问一道数学题:某中介服务机构项目所i涉及的金额按一定比例收取服务费,具体标准如下:1万元(含以下) 2020-07-28 …
从含有3件次品的8件产品中,任取2件,恰有1件次品的概率为?从含有3件次品的8件产品中,任取2件,恰 2020-11-10 …
10件产品中有2件次品,每次从中取3件,用x表示取出的3件中所含次品件数.(1)求x的分布列和数学期 2020-11-19 …
某中价服务机构根据服务项目所涉及的金额按一定比例收取服务费,具体标准如下:1万元(含)以下收取50元 2020-11-28 …
某中介服务机构项目所涉及的金额按一定比例收取服务费,具体标准如下:1万元(含)以下收取50元;1万元 2020-12-03 …