早教吧作业答案频道 -->化学-->
(1)已知:Fe(s)+12O2(g)=FeO(s)△H=-272.0kJ•mol-12Al(s)+32O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1Al和FeO发生铝热反应的热化学方程式是.(2)反
题目详情
(1)已知:Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ•mol-1 2Al(s)+
O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
Al和FeO发生铝热反应的热化学方程式是___.
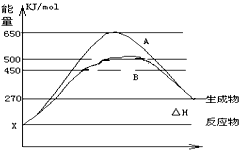
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是___(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___(填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为___ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g).
①该反应的平衡常数表达式为___.已知K1000℃<K1200℃,则该反应是___反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性___
(4)常温下,如果取0.1mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol•L-1NaOH溶液中水电离出的c(H+)比较___(填<、>、=).
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH___7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为___.(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
| 1 |
| 2 |
| 3 |
| 2 |
Al和FeO发生铝热反应的热化学方程式是___.
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是___(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___(填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为___ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g).
①该反应的平衡常数表达式为___.已知K1000℃<K1200℃,则该反应是___反应(填“吸热”或“放热”).
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性___
(4)常温下,如果取0.1mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol•L-1NaOH溶液中水电离出的c(H+)比较___(填<、>、=).
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH___7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为___.(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.

▼优质解答
答案和解析
(1)已知:①Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+
O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
据盖斯定律,将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大,故答案为:吸;增大;
②由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率,故答案为:D;
(3)①Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g),依据反应写出平衡常数K=
,已知K1000℃<K1200℃,温度升高平衡常数增大,则该反应是吸热反应,
故答案为:
;吸热;
②硫化钠溶于水溶液呈碱性,是因为硫离子水解的原因,反应的离子方程式为:S2-+H2O⇌HS-+OH-,故答为:S2-+H2O⇌HS-+OH-;
(4)①该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
②将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;(NH4)2SO4 和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵; NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大,则pH大小顺序为c>a>b>d,
故答案为:>;c>a>b>d.
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
据盖斯定律,将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大,故答案为:吸;增大;
②由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率,故答案为:D;
(3)①Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g),依据反应写出平衡常数K=
| [H2O]4 |
| [H2]4 |
故答案为:
| [H2O]4 |
| [H2]4 |
②硫化钠溶于水溶液呈碱性,是因为硫离子水解的原因,反应的离子方程式为:S2-+H2O⇌HS-+OH-,故答为:S2-+H2O⇌HS-+OH-;
(4)①该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
②将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;(NH4)2SO4 和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵; NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大,则pH大小顺序为c>a>b>d,
故答案为:>;c>a>b>d.
看了 (1)已知:Fe(s)+12...的网友还看了以下:
Indexexceedsmatrixdimensions.>>disp('');disp(''); 2020-04-26 …
已知函数f(j)=j3+aj-lnj,a∈7.(Ⅰ)若a=1,求曲线f(j)在点(1,f(1))处 2020-05-14 …
超级难算的数学题12*A+13*B+14*C+15*D+16*E+19*F+24*G+32*H+* 2020-05-14 …
“鞠躬尽瘁”的正确拼写形式是( )。A.jū gōng jìn cuìB.jū gōng jìng 2020-05-31 …
怎么得出G面试,另外三个是谁?F、G、J、K、L和M六人应聘某个职位.只有被面试才能被聘用.以下条 2020-06-08 …
Dy3+的4F9/2→6H13/2跃迁,其ΔJ=2,属电偶极跃迁,.Δl=0,Δs=0,ΔL=0, 2020-06-12 …
C语言求鞍点,哪里错了#include<stdio.h>intmain(){inti,j,k,ma 2020-07-23 …
对一般的二维数组G而言,当()时,其按行存储的G[I,J]的地址与按列存储的G[J,I]的地址相同 2020-07-31 …
[求助]函数突破了7层,如何换种方法表示?=IF(X3>0,"A",IF((W3+V3)>0,"B" 2020-10-31 …
函数极限问题设f(x)=g(x)/x,x不等于00,x=0且已知g(0)=g'(0)=0,g''(0 2020-12-08 …