早教吧作业答案频道 -->化学-->
(1)反应N2O4(g)⇌2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是..(2)在298K时,将0.40mol
题目详情
(1)反应N2O4(g)⇌2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是___..
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
20~40s内用N2O4表示的平均反应速率为___mol•L-1•s-1;298K时该反应的平衡转化率=___;反应进行至100s后将反应混合物的温度降低,混合气体的颜色___(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g)⇌N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:
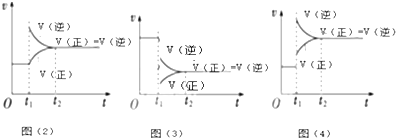
图(2)平衡将向___方向移动;图(3)引起平衡移动的因素是___,图(4)引起平衡移动的因素是___.
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)⇌N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向___方向移动;图(3)引起平衡移动的因素是___,图(4)引起平衡移动的因素是___.
▼优质解答
答案和解析
(1)该反应为吸热反应,升高温度,平衡向正反应方程移动,平衡常数增大,所以K3>K1>K2,
故答案为:K3>K1>K2;
(2)20s时△n(NO2)=0.24mol,故△n(N2O4)=
△n(NO2)=
×0.24mol=0.12mol,所以a=0.4mol-0.12mol=0.28mol,故20s~40s参加反应的四氧化二氮的物质的量为0.28mol-0.2mol=0.08mol,所以20s-40s内用N2O4表示的平均反应速率为
=0.002mol/(L•S);
N2O4(g)⇌2NO2(g)
起始(mol) 0.40 0
已转化(mol) 0.30 0.60
平衡(mol) 0.10 0.60
N2O4的平衡转化率=
×100%=75%;
该反应正反应是吸热反应,降低温度平衡向逆反应方向移动,NO2浓度减小,气体的颜色变浅,
故答案为:0.002;75%;变浅;
(3)根据图(2)可知,t1时逆反应速率大于正反应速率,所以此时反应逆向进行,由图(3)可知,t1时正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向移动,所以此时改变的条件是减小压强,由图(4)可知,t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,此时改变的条件是升高温度,
故答案为:正反应;减小压强,升高温度.
故答案为:K3>K1>K2;
(2)20s时△n(NO2)=0.24mol,故△n(N2O4)=
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 20s |
N2O4(g)⇌2NO2(g)
起始(mol) 0.40 0
已转化(mol) 0.30 0.60
平衡(mol) 0.10 0.60
N2O4的平衡转化率=
| 0.30 |
| 0.40 |
该反应正反应是吸热反应,降低温度平衡向逆反应方向移动,NO2浓度减小,气体的颜色变浅,
故答案为:0.002;75%;变浅;
(3)根据图(2)可知,t1时逆反应速率大于正反应速率,所以此时反应逆向进行,由图(3)可知,t1时正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向移动,所以此时改变的条件是减小压强,由图(4)可知,t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,此时改变的条件是升高温度,
故答案为:正反应;减小压强,升高温度.
看了 (1)反应N2O4(g)⇌2...的网友还看了以下:
ji个初2上的整式1.-3mxy的N次幂是关于X,Y的一个单项式,且系数为6,次数为5,则M=N= 2020-04-22 …
问一道现代控制理论的题已知系统的输入输出方程为试分别求出满足下述要求的状态空间表达式:y‘’+4y 2020-04-26 …
系数计算:公司有7128的奖金,一个7个人分,站长1.2系数,3个组长1.0系数,还有3个人是0. 2020-05-13 …
已知直线Ax+By+C=0,1.系数为什么值时,方程表示通过原点的直线2.系数满足什么关系时与坐标 2020-05-23 …
某调速系统的调速范围是150~1500,要求s=2%,系统允许的稳态速降是多少?如果开环系统的稳态 2020-06-16 …
下面的说法是否正确,并说明理由1系统的焓等于等压热.2系统的焓改变值ΔH等于等压热.3系统的焓等于 2020-06-17 …
奖金怎么分配给不同系数的人5000元分配给8个人啊,3个人1.5系数,3个人1.2系数,2个人1. 2020-07-16 …
单项式概念不懂的地方单项式中的数字因数叫做单项式的系数.比如3a系数是3,次数是1.那为什么单项式 2020-07-31 …
高二数学,杨辉三角.(ax+by)^n(ab已知,xy未知)中的系数之和等于(a+b)^n是吗?还有 2020-11-06 …
人教物理选修2系列和3系列有什么区别为什么人教新课标的物理的选修教材分三个个版本,内容和重心又不完全 2021-01-02 …