早教吧作业答案频道 -->化学-->
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.Ⅰ.(1)合成二甲醚反应一:3H2(g)+2CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol一定条件下该反应在密闭容器中达到平衡后,要
题目详情
二甲醚(CH 3 OCH 3 )被称为21世纪的清洁、高效能源.
Ⅰ.(1)合成二甲醚反应一:
3H 2 (g)+2CO(g)?CH 3 OCH 3 (g)+CO 2 (g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压 B、加催化剂 C、体积不变充入N 2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH 3 OH(g)?CH 3 OCH 3 (g)+H 2 O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH 3 OH,反应达到平衡,测得各组分的浓度如表:‘
该反应是______(填“放热”或“吸热”)反应,原因是______(从平衡常数角度说明).
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.
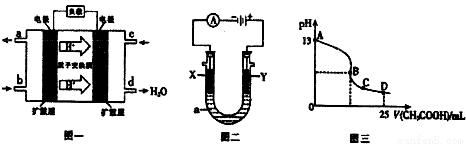
(1)该电池正极的电极反应式为______.
电池在放电过程中,b对应的电极溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为______ Cl 2 ↑+H 2 ↑+2OH -
Ⅰ.(1)合成二甲醚反应一:
3H 2 (g)+2CO(g)?CH 3 OCH 3 (g)+CO 2 (g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压 B、加催化剂 C、体积不变充入N 2
D、增加CO浓度 E、分离出二甲醚
(2)合成二甲醚反应二:2CH 3 OH(g)?CH 3 OCH 3 (g)+H 2 O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH 3 OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH 3 OH | CH 3 OCH 3 | H 2 O | ||
| 1 | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ.二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为______.
电池在放电过程中,b对应的电极溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,写出电解总反应的离子方程式为______ Cl 2 ↑+H 2 ↑+2OH -
▼优质解答
答案和解析
分析:
Ⅰ、(1)要提高CO的转化率,应使平衡向正反应分析移动;(2)计算出平衡,比较升高温度时平衡常数的变化,可判断反应热;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,由氢离子移动方向可知左侧电极为负极,右侧电极为正极;(2)电解KCl溶液,生成KOH、氢气和氧气;(3)醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,C点醋酸过量,溶液呈酸性.
Ⅰ、(1)A正反应放热,则降低温度可使平衡向正方向移动,增大压强平衡向正方向移动,故A正确;B.加入催化剂平衡不移动,故B错误;C.体积不变充入N2,平衡不移动,故C错误;D.增加CO浓度,CO的转化率降低,故D错误;E.分离出二甲醚,可使平衡向正方向移动,故答案为:AE;(2)平衡时K(403)==400,K(453)==300,说明升高温度平衡常数减小,则反应向逆方向移动,所以正反应应为放热反应,故答案为:放热;K(403)==400,K(453)==300,K(403)>K(453),所以该反应为放热反应;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,电极反应为4H++O2+4e-=2H2O,由氢离子移动方向可知左侧电极为负极,右侧电极为正极,负极反应为CH3OCH3+3H2O-12e-=12H++2CO2,生成H+,pH减小,故答案为:4H++O2+4e-=2H2O;减小;(2)电解KCl溶液,生成KOH、氢气和氧气,总反应式为2Cl-+2H2OCl2↑+H2↑+2OH-,故答案为:2Cl-+2H2OCl2↑+H2↑+2OH-;(3)①醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,应为与AB之间,故答案为:AB;②C点醋酸过量,溶液呈酸性,应有c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
点评:
本题考查较为综合,涉及化学平衡的移动,原电池与电解池以及离子浓度的大小比较,题目难度中等,注意把握电极方程式的书写以及平衡常数的意义.
分析:
Ⅰ、(1)要提高CO的转化率,应使平衡向正反应分析移动;(2)计算出平衡,比较升高温度时平衡常数的变化,可判断反应热;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,由氢离子移动方向可知左侧电极为负极,右侧电极为正极;(2)电解KCl溶液,生成KOH、氢气和氧气;(3)醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,C点醋酸过量,溶液呈酸性.
Ⅰ、(1)A正反应放热,则降低温度可使平衡向正方向移动,增大压强平衡向正方向移动,故A正确;B.加入催化剂平衡不移动,故B错误;C.体积不变充入N2,平衡不移动,故C错误;D.增加CO浓度,CO的转化率降低,故D错误;E.分离出二甲醚,可使平衡向正方向移动,故答案为:AE;(2)平衡时K(403)==400,K(453)==300,说明升高温度平衡常数减小,则反应向逆方向移动,所以正反应应为放热反应,故答案为:放热;K(403)==400,K(453)==300,K(403)>K(453),所以该反应为放热反应;Ⅱ、(1)正极发生还原反应,氧气得电子被还原,电极反应为4H++O2+4e-=2H2O,由氢离子移动方向可知左侧电极为负极,右侧电极为正极,负极反应为CH3OCH3+3H2O-12e-=12H++2CO2,生成H+,pH减小,故答案为:4H++O2+4e-=2H2O;减小;(2)电解KCl溶液,生成KOH、氢气和氧气,总反应式为2Cl-+2H2OCl2↑+H2↑+2OH-,故答案为:2Cl-+2H2OCl2↑+H2↑+2OH-;(3)①醋酸为弱酸,恰好中和时溶液呈碱性,pH>7,应为与AB之间,故答案为:AB;②C点醋酸过量,溶液呈酸性,应有c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
点评:
本题考查较为综合,涉及化学平衡的移动,原电池与电解池以及离子浓度的大小比较,题目难度中等,注意把握电极方程式的书写以及平衡常数的意义.
看了 二甲醚(CH3OCH3)被称...的网友还看了以下:
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡 2020-04-12 …
在化合反应、分解的反应、置换反应、复分解反应这四种基本反应类型中,一定有化合物生成的反应有()A. 2020-05-13 …
某制备氢气新工艺的主要流程如下:(1)“设备1”中的反应在常温下进行,该反应属于基本反应类型中的反 2020-05-14 …
漂白粉在空气中放置易失效的主要原因是()A.Ca(ClO)2不稳定,易分解B.Ca(ClO)2易吸 2020-05-17 …
诊断遗尿症,患儿的年龄应在A.2岁以后B.3岁以后C.斗岁以后D.5岁以后E.6岁以后 2020-06-04 …
ABS合成树脂的结构可表示为则生成该树脂的单体的种类和化学反应所属类型正确的是()A.1种加聚反应 2020-06-09 …
网球双打的接发球次序先接球的一方,应在第1局开始时,决定何人先接发球,并在这盘单数局,继续先接发球 2020-06-22 …
在计算极值.拐点.最值是否都应考虑导数不存在点.如果原函数在导数不存在点有对应值.这样不存在的点为 2020-06-30 …
求一篇英语作文-HowWasComputerInvented为题至少要包括以下几点:1.计算机有悠 2020-08-03 …
下列关于丙醇的叙述中,正确的是()A.1丙醇与氧气的混合气体通过赤热的铜,可生成CH3CH2CHOB 2020-10-30 …