早教吧作业答案频道 -->化学-->
高铁酸盐在能源、环保等方面有着广泛的用途.Ⅰ.高铁酸钾(K2FeO3)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中.如图1是高铁电池的模拟实验装置:(1)该电池放电时
题目详情
高铁酸盐在能源、环保等方面有着广泛的用途.
Ⅰ.高铁酸钾(K2FeO3)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中.如图1是高铁电池的模拟实验装置:
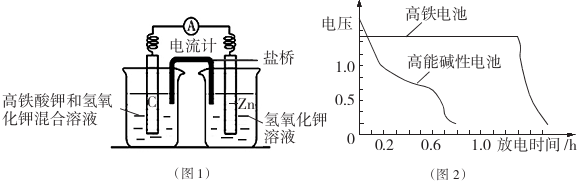
(1)该电池放电时正极的电极反应式为___;若维持电流强度为1A,电池工作十分钟,理论消耗Zn___g(已知F=96500C/mol).
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___移动(填“左”或“右”);若用阳离
子交换膜代替盐桥,则钾离子向___移动(填“左”或“右”).
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___.
Ⅱ、工业上湿法制备K2Fe04的工艺流程如图3.
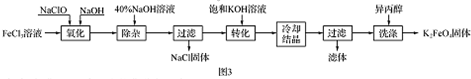
(4)完成“氧化”过程中反应的化学方程式:
___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O
(5)加入饱和KOH溶液的目的是___
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入___mL 2mol/L的盐酸(忽略加入盐酸体积).
Ⅰ.高铁酸钾(K2FeO3)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中.如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为___;若维持电流强度为1A,电池工作十分钟,理论消耗Zn___g(已知F=96500C/mol).
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___移动(填“左”或“右”);若用阳离
子交换膜代替盐桥,则钾离子向___移动(填“左”或“右”).
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___.
Ⅱ、工业上湿法制备K2Fe04的工艺流程如图3.

(4)完成“氧化”过程中反应的化学方程式:
___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O
(5)加入饱和KOH溶液的目的是___
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入___mL 2mol/L的盐酸(忽略加入盐酸体积).
▼优质解答
答案和解析
Ⅰ.(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,左边烧杯只能生成三价铁,三价铁离子在碱溶液中沉淀下来,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若维持电流强度为1A,电池工作十分钟,通过电子为
,则理论消耗Zn为
×
×65g/mol=0.2g,
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;0.2;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动,
故答案为:右;左;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定,
故答案为:使用时间长、工作电压稳定;
Ⅱ.氯化铁溶液中加入次氯酸钠和氢氧化钠,发生反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶、过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(4)其中Fe元素化合价由+3价升高为+6价,共升高3价,Cl元素化合价由+1价降低为-1,价,共降低2价,化合价升降最小公倍数为6,则FeCl3的系数为2、NaClO的系数为3,再根据原子守恒配平后反应方程式为:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,
故答案为:2、10、3、2、9、5;
(5)加入饱和KOH溶液可以增大K+的浓度,减小高铁酸钾的溶解,促进高铁酸钾晶体析出,
故答案为:减小高铁酸钾的溶解,促进高铁酸钾晶体析出;
(6)溶液中c(Fe3+)=5mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知开始沉淀时c(OH-)=2×10-13mol/L,则溶液中c(H+)=
mol/L=0.05mol/L,根据稀释定律,需要盐酸的体积为
=2.5mL,
故答案为:2.5.
| 1A×600s |
| 96500C/mol |
| 1A×600s |
| 96500C/mol |
| 1 |
| 2 |
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;0.2;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动,
故答案为:右;左;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定,
故答案为:使用时间长、工作电压稳定;
Ⅱ.氯化铁溶液中加入次氯酸钠和氢氧化钠,发生反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶、过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(4)其中Fe元素化合价由+3价升高为+6价,共升高3价,Cl元素化合价由+1价降低为-1,价,共降低2价,化合价升降最小公倍数为6,则FeCl3的系数为2、NaClO的系数为3,再根据原子守恒配平后反应方程式为:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,
故答案为:2、10、3、2、9、5;
(5)加入饱和KOH溶液可以增大K+的浓度,减小高铁酸钾的溶解,促进高铁酸钾晶体析出,
故答案为:减小高铁酸钾的溶解,促进高铁酸钾晶体析出;
(6)溶液中c(Fe3+)=5mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知开始沉淀时c(OH-)=2×10-13mol/L,则溶液中c(H+)=
| 10-14 |
| 2×10-13 |
| 0.05mol/L×100mL |
| 2mol/L |
故答案为:2.5.
看了 高铁酸盐在能源、环保等方面有...的网友还看了以下:
绳上有铁环,铁环重力方向与两段绳角度不同,可为什么这两段绳对铁环力的大小相同? 2020-04-26 …
两个铁环滚过一段距离,一个转了50圈、另一个转了40圈如果一个铁环比另一个铁环的半径少10厘米,这 2020-04-27 …
同学们,你了解父母的童年吗?滚铁环就是你们父母童年时最流行的一种游戏,如图所示,关于这种游戏,下列 2020-05-02 …
如图,小明在一条路上滚铁环,铁环的直径是30厘米,滚了47.1米,问铁环滚动了几圈?(精确到1圈) 2020-05-13 …
螺栓固定在铁环中央用什么填充 热熔胶 还是塑料融化重定型?我是想把一个螺丝固定在一个铁环的中央,因 2020-05-14 …
一个筒的外直径是6分米在它的外面加一道铁环铁环接头处长0.16分米铁环长多少分米 2020-05-17 …
一个铁桶的外直径是5.2分米,在它的外面加个铁环,铁环接头处长0.4分米,这个铁环长多少米? 2020-05-17 …
滚铁环是一种有趣的儿童游戏,如果用一根长90厘米发的铁片弯成一个圆形铁环,这个铁环的半径大约是多少 2020-06-19 …
(2011•新昌县模拟)如图①是一个小朋友玩“滚铁环”的游戏,将这个游戏抽象为数学问题如图②,已知铁 2020-12-19 …
智力铁环玩具(中间有个4角铁星)如何拿出这个玩具看似很简单,一个椭圆形粗铁环(环的横截面有变化),里 2020-12-19 …