早教吧作业答案频道 -->化学-->
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).已知:①CO(g)+12O2(g)═CO2(g)△H1=-283.0kJ/mol②H2(g)+1
题目详情
甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)⇌CH3OH(g).
已知:
①CO(g)+
O2(g)═CO2(g)△H1=-283.0kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-241.8kJ/mol
③CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)⇌CH3OH(g)的反应热△H4=___.
(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g)⇌CH3OH(g)反应,下列示意图(a-d)正确且能说明反应在进行到t1时刻为平衡状态的是___(填选项字母).
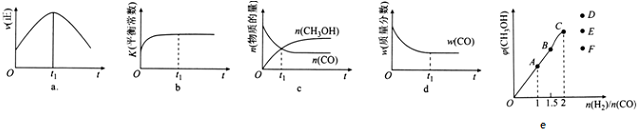
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=___.T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,则该容器的体积___5L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K=___.
(4)在T1℃时,在体积为5L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图e所示.温度不变,当
=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的___点.
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___.该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___.
(6)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可.写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___.
已知:
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
回答下列问题:
(1)计算CO(g)+2H2(g)⇌CH3OH(g)的反应热△H4=___.
(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g)⇌CH3OH(g)反应,下列示意图(a-d)正确且能说明反应在进行到t1时刻为平衡状态的是___(填选项字母).

(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=___.T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,则该容器的体积___5L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K=___.
(4)在T1℃时,在体积为5L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图e所示.温度不变,当
| n(H2) |
| n(CO) |
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___.该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___.
(6)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可.写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___.
▼优质解答
答案和解析
(1)①CO(g)+
O2(g)═CO2(g)△H1=-283.0kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-241.8kJ/mol
③CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H3=-192.2kJ/mol
盖斯定律计算①+②×2-③,得到CO(g)+2H2(g)⇌CH3OH(g)△H4=-574.4KJ/mol,
故答案为:-574.4KJ/mol;
(2)a、图1表示t1时刻如果达平衡,正反应速率不变,而不是随时间间改变而减小,故a错误;
b、充入1molCO、2molH2,生成生成物甲醇,放出热量,反应体系的温度升高,K减小,而不是增大,故b错误;
c、一氧化碳与甲醇的物质的量相等,而不是平衡状态,故c错误;
d、随着反应的进行,一氧化碳的质量减小,一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态,故d正确;
故选d,
故答案为:d;
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,化学三行计算列式得到,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.2 0.4 0
变化量(mol/L) 0.16 0.32 0.16
平衡量(mol/L) 0.04 0.08 0.16
则5min内用H2表示的反应速率为v(H2)=
=0.064mol/(L•L),
温度不变,T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,转化率减小说明平衡左移,体积增大,T1℃时,CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K=
=625,
故答案为:0.064mol/(L•L);>;625;
(4)当容器中各物质的物质的量之比等于化学方程式计量数之比时,达到平衡状态时生成物的体积分数最大,所以当
小于2,平衡时甲醇的体积分数逐渐增大,当
大于2,平衡时甲醇体积分数减小,所以C点对应的甲醇的体积分数最大,当
=2.5时,平衡时甲醇体积分数会降低,应选F点,
故答案为:F;
(5)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,是利用铁闸做电解池阴极被保护,名称为:外加电源的阴极保护法,
故答案为:CH3OH+8OH--6e-═CO32-+6H2O;外加电源的阴极保护法;
(6)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
故答案为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
盖斯定律计算①+②×2-③,得到CO(g)+2H2(g)⇌CH3OH(g)△H4=-574.4KJ/mol,
故答案为:-574.4KJ/mol;
(2)a、图1表示t1时刻如果达平衡,正反应速率不变,而不是随时间间改变而减小,故a错误;
b、充入1molCO、2molH2,生成生成物甲醇,放出热量,反应体系的温度升高,K减小,而不是增大,故b错误;
c、一氧化碳与甲醇的物质的量相等,而不是平衡状态,故c错误;
d、随着反应的进行,一氧化碳的质量减小,一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态,故d正确;
故选d,
故答案为:d;
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,化学三行计算列式得到,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.2 0.4 0
变化量(mol/L) 0.16 0.32 0.16
平衡量(mol/L) 0.04 0.08 0.16
则5min内用H2表示的反应速率为v(H2)=
| 0.32mol/L |
| 5min |
温度不变,T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,转化率减小说明平衡左移,体积增大,T1℃时,CO(g)+2H2(g)⇌CH3OH(g)的平衡常数K=
| 0.16 |
| 0.04×0.082 |
故答案为:0.064mol/(L•L);>;625;
(4)当容器中各物质的物质的量之比等于化学方程式计量数之比时,达到平衡状态时生成物的体积分数最大,所以当
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
故答案为:F;
(5)燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,是利用铁闸做电解池阴极被保护,名称为:外加电源的阴极保护法,
故答案为:CH3OH+8OH--6e-═CO32-+6H2O;外加电源的阴极保护法;
(6)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水2,所以反应方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O,
故答案为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O;
看了 甲醇是一种优质燃料,在工业上...的网友还看了以下: