早教吧作业答案频道 -->化学-->
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl实验一:
题目详情
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
实验一:制备NaClO溶液.(实验装置如图1所示)
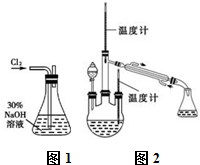
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___(填标号).
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式是___.
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10mol•L-1盐酸、酚酞试液):___.
实验二:制取水合肼.(实验装置如右图2所示)
(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.分液漏斗中的溶液是___(填标号).A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液,原因是:___(用化学方程式表示).
实验三:测定馏分中肼含量.
(5)①称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol•L-1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右.(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)
滴定时,碘的标准溶液盛放在___(填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为___.
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为___.
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
实验一:制备NaClO溶液.(实验装置如图1所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___(填标号).
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式是___.
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10mol•L-1盐酸、酚酞试液):___.
实验二:制取水合肼.(实验装置如右图2所示)
(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.分液漏斗中的溶液是___(填标号).A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液,原因是:___(用化学方程式表示).
实验三:测定馏分中肼含量.
(5)①称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol•L-1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右.(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)
滴定时,碘的标准溶液盛放在___(填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为___.
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为___.
▼优质解答
答案和解析
(1)用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,
故选:BD,
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)用过氧化氢除去溶液中NaClO,用酚酞作指示剂,用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次,
故答案为:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次;
(4)N2H4•H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,应将NaOH和NaClO混合溶液滴入CO (NH2) 2溶液中,故分液漏斗中盛放的为,NaOH和NaClO混合溶液,
故答案为:B;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,
故答案为:酸式;溶液出现蓝色且半分钟内不消失;
②设馏分中水合肼(N2H4•H2O)的质量分数为a,则:
N2H4•H2O+2I2=N2↑+4HI+H2O
50g 2mol
5g×a 0.018L×0.1mol/L×
所以50g:5g×a=2mol:0.018L×0.1mol/L×
解得a=9%,
故答案为:9%.
故选:BD,
(2)锥形瓶中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)用过氧化氢除去溶液中NaClO,用酚酞作指示剂,用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次,
故答案为:取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol•L-1盐酸滴定,重复上述操作2~3次;
(4)N2H4•H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,应将NaOH和NaClO混合溶液滴入CO (NH2) 2溶液中,故分液漏斗中盛放的为,NaOH和NaClO混合溶液,
故答案为:B;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中;肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,
故答案为:酸式;溶液出现蓝色且半分钟内不消失;
②设馏分中水合肼(N2H4•H2O)的质量分数为a,则:
N2H4•H2O+2I2=N2↑+4HI+H2O
50g 2mol
5g×a 0.018L×0.1mol/L×
| 250mL |
| 25mL |
所以50g:5g×a=2mol:0.018L×0.1mol/L×
| 250mL |
| 25mL |
解得a=9%,
故答案为:9%.
看了 水合肼(N2H4•H2O)又...的网友还看了以下:
1.用起重机把重量为2.0×10⁴N的物体匀速地提高了5m,钢绳的拉力做了多少功?重力做了多少功? 2020-06-02 …
关于英语学习交流我是一名重点中学的高一学生.我的英语成绩不错,在单科年级排名名列前茅.自己懂的语法 2020-06-11 …
如何才能使我的英语变稳定我是一名重点高中的学生,我成绩一直都不错,进入高中之后,老师都讽刺我喜欢爆 2020-06-25 …
国际上流行“磅”这种质量单位,1磅=0.4536kg,一名重量级拳击运动员的质量为250磅,相当于 2020-07-05 …
一名重症病人手术时需要输血2000毫升,340升血液可以帮助多少名重症病人手术? 2020-07-09 …
电梯载着一名重750N的乘客,以2.0m/s的速度匀速上升,电机的输出功率为1.5×104W.求: 2020-07-09 …
一名富翁在家里被某害,法医鉴定死亡时间是在深夜11点到12点之间.警察局抓住了一名重要的嫌疑人,但 2020-08-04 …
国际上还流行“磅”这种质量单位,1磅=0.4536kg,一名重量级拳击运动员质量为250磅,那么25 2020-10-30 …
国际上还流行“磅”这种质量单位,1磅=0.4536kg.一名重量级拳击运动员质量为250磅,那么25 2020-10-30 …
死海是著名的旅游胜地,它的海水密度很大,人可以自然的浮在水面,有一名重为525N的游客躺在死海的水面 2020-11-03 …