早教吧作业答案频道 -->化学-->
合理应用和处理含氮的化合物,在生产生活中有重要意义.(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示.写出总反应化学方程式.(2)已知N2(g)+3H2(g)⇌
题目详情
合理应用和处理含氮的化合物,在生产生活中有重要意义.
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示.
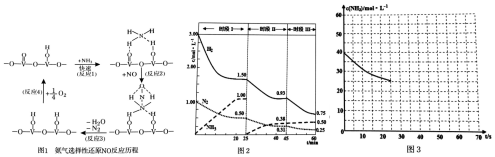
写出总反应化学方程式___.
(2)已知N2(g)+3H2(g)⇌2NH3(g)△H=-94.4gKJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.
①在2L容器中发生反应,前20min内,v(NH3)=___,放出的热量为___.
②25min时采取的措施是___.
③时段III条件下,反应的平衡常数表达式为___(只列计算表达式,不计算).
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)⇌0CO(NH2)2(s)+H2O(g);△H<0.某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%.图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化.其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线.
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示.

写出总反应化学方程式___.
(2)已知N2(g)+3H2(g)⇌2NH3(g)△H=-94.4gKJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.
①在2L容器中发生反应,前20min内,v(NH3)=___,放出的热量为___.
②25min时采取的措施是___.
③时段III条件下,反应的平衡常数表达式为___(只列计算表达式,不计算).
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)⇌0CO(NH2)2(s)+H2O(g);△H<0.某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的妆花率为50%.图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化.其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线.
▼优质解答
答案和解析
(1)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2
4N2+6H2O,
故答案为:4NH3+4NO+O2
4N2+6H2O;
(2)①根据图象可知,20min时氨气的物质的量浓度为1.00mol/L,所以氨气的平均反应速率为:v(NH3)=
=0.050mol(L•min)-1;
达到平衡时生成的氨气的物质的量为:1.00 mol/L×1L=1.00mol,
根据N2(g)+3H2(g)⇌2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨气放出的热量为94.4kJ,
故答案为:0.050mol(L•min)-1; 94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时改变的条件是将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应为:N2(g)+3H2(g)⇌2NH3(g),图象方向可知平衡状态下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,该反应的化学平衡常数为:K=
=
,
故答案为:
;
(3)2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g),反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度20mol/L×50%=10mol/L;
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol/L) 40 20 0 0
变化量(mol/L) 20 10 0 10
平衡量(mol/L) 20 10 0 10
若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: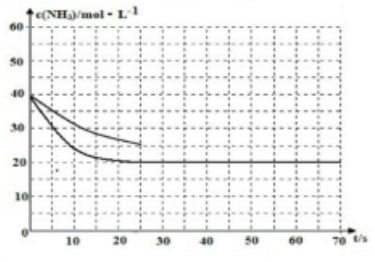 ,
,
故答案为: .
.
| ||
故答案为:4NH3+4NO+O2
| ||
(2)①根据图象可知,20min时氨气的物质的量浓度为1.00mol/L,所以氨气的平均反应速率为:v(NH3)=
| 1.00mol/L |
| 20min |
达到平衡时生成的氨气的物质的量为:1.00 mol/L×1L=1.00mol,
根据N2(g)+3H2(g)⇌2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨气放出的热量为94.4kJ,
故答案为:0.050mol(L•min)-1; 94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时改变的条件是将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应为:N2(g)+3H2(g)⇌2NH3(g),图象方向可知平衡状态下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,该反应的化学平衡常数为:K=
| c2(NH3) |
| c3(H2)c(N2) |
| (0.50mol/L)2 |
| (0.75mol/L)3×0.25mol/L |
故答案为:
| (0.50mol/L)2 |
| (0.75mol/L)3×0.25mol/L |
(3)2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g),反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度20mol/L×50%=10mol/L;
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol/L) 40 20 0 0
变化量(mol/L) 20 10 0 10
平衡量(mol/L) 20 10 0 10
若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示:
 ,
,故答案为:
 .
.
看了 合理应用和处理含氮的化合物,...的网友还看了以下:
1 mol FeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒用NA表示阿伏加德罗常数的 2020-04-05 …
类推是科学学习中常用的思维方法,下列类推结果中正确的是()A.酸和碱反应生成盐和水,生成盐和水的反 2020-05-13 …
逻辑推理是一种重要的科学思维方法,下列推理合理的是()A.因为酸与碱反应生成盐和水,所以生成盐和水 2020-05-13 …
推理是化学学习中常用的方法.下列推理正确的是()A.酸与碱反应生成盐和水,生成盐和水的反应一定是中 2020-05-13 …
推理是研究和学习化学的一种重要方法.以下推理正确的是()A.酸碱发生中和反应生成盐和水,所以生成盐 2020-05-14 …
11.A、B、C、D、F五种物质的都含有Na元素,A、B、C、D与盐酸反应均生成E,此外B还生成一 2020-05-20 …
ABCD是4种含硅元素的物质.满足1C与烧碱反应生成A和水2A溶液与钙盐溶液反应生成白色沉淀D3B 2020-05-21 …
为什么1mol某链烃最多能和2molHCl发生加成反应,分子中就含有2个C=C键或1个C≡C例:1 2020-06-05 …
书上说:银镜反应的反应本质是这个反应里,硝酸银与氨水生成的银氨溶液中含有氢氧化二氨合银,这是一种弱 2020-07-03 …
工业上以黄铁矿(主要成分FeS2,杂质不含硫元素)为原料生产硫酸.其反应原理为:①FeS2与O2高温 2020-12-02 …