早教吧作业答案频道 -->化学-->
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0
题目详情
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0kJ/mol
NO2(g)═
N2O4(g)△H=-28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式___.
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=___;达到平衡时NO2转化率=___;计算该温度下该反应的化学平衡常数K=___(填数值).
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(g)△H
该反应在一定条件下能自发进行的原因是___;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___(填序号).
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
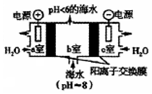
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域.有人利用如图所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95%以HCO3-存在),有利于减少环境中温室气体含量.
①a室的电极反应式为___.
②b室中提取CO2的反应的离子方程式为___.
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海.处理的方法是___.

(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0kJ/mol
NO2(g)═
| 1 |
| 2 |
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式___.
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=___;达到平衡时NO2转化率=___;计算该温度下该反应的化学平衡常数K=___(填数值).
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)
| 一定条件 |
| |
该反应在一定条件下能自发进行的原因是___;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___(填序号).
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域.有人利用如图所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95%以HCO3-存在),有利于减少环境中温室气体含量.
①a室的电极反应式为___.
②b室中提取CO2的反应的离子方程式为___.
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海.处理的方法是___.
▼优质解答
答案和解析
(1)已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
Ⅱ、2NO2(g)⇌N2O4(g)△H2=-57kJ/mol
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-57kJ/mol)=-810kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810kJ/mol;
(2)NO2(g)+SO2(g)═SO3(g)+NO(g)
起始物质的量浓度(mol/L) 1 2 0 0
变化物质的量浓度(mol/L) 0.75 0.75 0.75 0.75
平衡物质的量浓度(mol/L) 0.25 1.25 0.75 0.75
则10s内反应的平均速率v(SO2)=
=0.075 mol/(L•s);
达到平衡时NO2转化率=
×100%=75%;
该温度下该反应的化学平衡常数K=
=1.8;
故答案为:0.075 mol/(L•s);75%;1.8;
(3)2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△S<0,此反应能自发进行,即△G=△H-T△S<0,则△H<0;
2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H<0,反应是气体体积减小的放热反应;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;
d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;
故答案为:△H<0;bd;
(4)①a室为阳极,发生氧化反应,电极方程式为2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;
②氢离子通过阳离子交换膜进入b室,发生反应H++HCO3-=CO2↑+H2O,故答案为:H++HCO3-=CO2↑+H2O;
③c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准,
故答案为:用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH.
Ⅱ、2NO2(g)⇌N2O4(g)△H2=-57kJ/mol
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-57kJ/mol)=-810kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810kJ/mol;
(2)NO2(g)+SO2(g)═SO3(g)+NO(g)
起始物质的量浓度(mol/L) 1 2 0 0
变化物质的量浓度(mol/L) 0.75 0.75 0.75 0.75
平衡物质的量浓度(mol/L) 0.25 1.25 0.75 0.75
则10s内反应的平均速率v(SO2)=
| 0.75mol/L |
| 10s |
达到平衡时NO2转化率=
| 0.75mol/L |
| 1mol/L |
该温度下该反应的化学平衡常数K=
| 0.75×0.75 |
| 0.25×1.25 |
故答案为:0.075 mol/(L•s);75%;1.8;
(3)2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△S<0,此反应能自发进行,即△G=△H-T△S<0,则△H<0;
2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H<0,反应是气体体积减小的放热反应;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;
d.反应前后问题密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;
故答案为:△H<0;bd;
(4)①a室为阳极,发生氧化反应,电极方程式为2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;
②氢离子通过阳离子交换膜进入b室,发生反应H++HCO3-=CO2↑+H2O,故答案为:H++HCO3-=CO2↑+H2O;
③c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准,
故答案为:用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH.
看了 为保护环境,应减少二氧化硫、...的网友还看了以下:
下列关于氧气性质的说法正确是A红磷可以在氧气中燃烧,产生大量白雾B发生氧化反应总会发光发热C铁丝在空 2020-03-31 …
煤燃烧的反应热可通过以下两个途径来利用:A.利用煤在充足的空气中直接燃烧产煤燃烧的反应热可通过以下 2020-04-11 …
A+B→C+D是实验室药品保存不当常发生的反应,其中B、D是常用灭火剂,A、C溶液均显碱性,该反应 2020-05-14 …
热化学方程式中,一摩尔反应指什么?在燃烧反应的热化学反应方程式中,一摩尔反应指一摩尔可燃物发生了反 2020-06-27 …
青春期的卫生保健应当注意些什么(至少三条)? 2020-06-27 …
燃烧是人类获取能量的重要反应,在生活和生成中应用广泛.(1)木炭在氧气中燃烧时的现象为,文字表达式 2020-07-21 …
求教,为什么生物燃料排放的二氧化碳和化石燃料同样多,却更环保?如题!其实这是我们的作业题,Whybi 2020-11-04 …
当物质完全燃烧时,发生的燃烧反应与四种基本反应类型关系的说法中,正确的是()A.燃烧反应一定属于化合 2020-11-20 …
男性养生保健应特别注意不要焦躁 2021-04-06 …
夏季养生保健应该多食三种粥 2021-04-08 …