早教吧作业答案频道 -->化学-->
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与
题目详情
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与水反应的化学方程式:___.
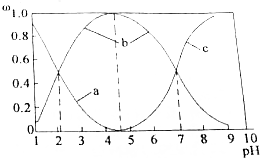
②与SOCl2中硫元素同价态的硫的含氧酸在溶液中存在三种含硫微粒,条件该含氧酸溶液的pH值,三种含硫微粒的物质的量分数(ω)随pH变化曲线如图所示:按顺序写出a、b、c代表的三种微粒的化学式___;该含氧酸二级电离平衡常数Ka2=___.
(2)直接加热AlCl3•6H2O固体过程中会生成中间产物碱式氯化铝[Al2(OH)nCl(6-n)].
①若
×100%=40%,则n=___(结果保留整数)
②将AlCl3•6H2O固体与氯化亚砜混合后加热可得无水AlCl3,试分析氯化亚砜所起的作用:___;
(3)SOCl2不稳定,加热到一定温度可分解生成Cl2、SO2、S2Cl2(常温下呈液态),写出分解的方程式:___,当转移3mol电子时,所得氧化产物的物质的量为___.
(4)一种新型超级可充电电池以金属锂和SOCl2分别作负极、正极的活性物质,电解液为LiAlCl4-SOCl2,放电时生成LiCl、S、SO2,写出充电时阳极电极反应式:___.

(1)氯化亚砜遇水会产生白雾,并产生能使品红溶液褪色的气体.①写出氯化亚砜与水反应的化学方程式:___.
②与SOCl2中硫元素同价态的硫的含氧酸在溶液中存在三种含硫微粒,条件该含氧酸溶液的pH值,三种含硫微粒的物质的量分数(ω)随pH变化曲线如图所示:按顺序写出a、b、c代表的三种微粒的化学式___;该含氧酸二级电离平衡常数Ka2=___.
(2)直接加热AlCl3•6H2O固体过程中会生成中间产物碱式氯化铝[Al2(OH)nCl(6-n)].
①若
| m(碱式氯化铝) |
| m(起始AlCl3•6H2O) |
②将AlCl3•6H2O固体与氯化亚砜混合后加热可得无水AlCl3,试分析氯化亚砜所起的作用:___;
(3)SOCl2不稳定,加热到一定温度可分解生成Cl2、SO2、S2Cl2(常温下呈液态),写出分解的方程式:___,当转移3mol电子时,所得氧化产物的物质的量为___.
(4)一种新型超级可充电电池以金属锂和SOCl2分别作负极、正极的活性物质,电解液为LiAlCl4-SOCl2,放电时生成LiCl、S、SO2,写出充电时阳极电极反应式:___.
▼优质解答
答案和解析
(1)①产生能使品红溶液褪色的气体为SO2,还生成HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,a为H2SO3,b为HSO3-,c为SO32-,
亚硫酸二级电离为:HSO3-⇌H++SO32-,二级电离常数Ka2=
,由图可知pH=7时,溶液中c(HSO3-)=c(SO32-),则二级电离常数Ka2=
=c(H+)=10-7,
故答案为:H2SO3、HSO3-、SO32-;10-7;
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,则
×100%=40%,解得n=4
②AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解,
故答案为:AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,反应方程式为:4SOCl2
3Cl2↑+2SO2↑+S2Cl2,反应中氯气是氧化产物,S2Cl2还原产物,当转移3mol电子时,所得氧化产物的物质的量为
=1.5mol,
故答案为:4SOCl2
3Cl2↑+2SO2↑+S2Cl2;1.5mol;
(4)电池总反应为:4Li+2SOCl2 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
故答案为:4Cl-+S+SO2-4e-=2SOCl2.
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②与SOCl2中硫元素同价态的硫的含氧酸为H2SO3,随碱性增强,H2SO3浓度减小、HSO3-浓度增大,碱性较强时主要以SO32-存在,a为H2SO3,b为HSO3-,c为SO32-,
亚硫酸二级电离为:HSO3-⇌H++SO32-,二级电离常数Ka2=
| c(H+)×c(SO32-) |
| c(HSO3-) |
| c(H+)×c(SO32-) |
| c(HSO3-) |
故答案为:H2SO3、HSO3-、SO32-;10-7;
(2)①设AlCl3•6H2O为2mol,由Al元素守恒可知Al2(OH)nCl(6-n)为1mol,则
| 54+17n+35.5(6-n) |
| 2×(27+3×35.5+6×18) |
②AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解,
故答案为:AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(3)SOCl2加热到一定温度可分解生成Cl2、SO2、S2Cl2,反应方程式为:4SOCl2
| ||
| 3mol |
| 2 |
故答案为:4SOCl2
| ||
(4)电池总反应为:4Li+2SOCl2
 4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,
4LiCl+S+SO2,充电时,阳极发生氧化反应,S失去电子,在二氧化硫、氯离子参与下生成SOCl2,阳极电极反应式为:4Cl-+S+SO2-4e-=2SOCl2,故答案为:4Cl-+S+SO2-4e-=2SOCl2.
看了 氯化亚砜(SOCl2)液体是...的网友还看了以下:
张阿姨有格子铺40个当每个格子会的月租金为270元时恰好全部出租在此基础上当每个月租金提高10元时 2020-04-06 …
英语翻译1.具有很高的天赋2.作曲3.在欧洲各地演出4.在他父亲的教导下5.一生有杰出的贡献6.最 2020-04-11 …
磨刀霍霍向猪羊演化出的成语是什么 2020-04-27 …
根据有关调查,有清晰目标的人大多能够取得成功,而目标模糊的人则往往没有突出的成就,这一事实直接说明 2020-05-13 …
初三上化学前两章学习要求掌握的所有化学方程式有喜有忧.为学习到新学科高兴.又为新学科的困难困惑.老 2020-05-13 …
新型有机高分子材料希望能有详细的图文解释,如果能有化学的结构式更好了~主要是想知道它的用途,应用. 2020-05-13 …
关于B细胞和T细胞的叙述,正确的是()A.都能产生免疫活性物质抗体,参与机体的免疫作用B.B细胞只 2020-05-14 …
离婚案件当时没有提出的问题明天提出来是否可以继续受理?领结婚证后结婚证丢失而所有证人都不在了怎样处 2020-05-21 …
鱼我所欲也一文演化出的成语 2020-05-21 …
判断1.霉菌都是有害的.2地层中含有化石的是变质石.3.空气与铁生锈无关.4所有恐龙灭绝的理论都是 2020-05-23 …