早教吧作业答案频道 -->化学-->
Na2S2O3可做分析试剂.它易溶于水,遇酸易分解.某研究小组进行如下实验:实验一Na2S2O3•5H2O的制备Ⅰ实验原理:Na2SO3(aq)+S(s)△
题目详情
Na2S2O3可做分析试剂.它易溶于水,遇酸易分解.某研究小组进行如下实验:
【实验一】Na2S2O3•5H2O的制备
Ⅰ实验原理:Na2SO3(aq)+S(s)
Na2S2O3(aq)
Ⅱ实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
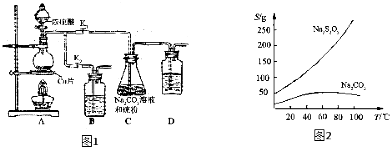
Ⅲ实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是___,装置 C中的硫粉应事先研细并用乙醇润湿,否则会影响___.
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式:___.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热.采取该措施的理由是___.
(4)将C中的混合液过滤,将滤液经过___、___、过滤、洗涤、烘干,可得粗产品Na2S2O3•5H2O.
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:___.
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯.测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯.再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积.
(已知:滴定时反应的化学方程式为I2+2Na2SO3═2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为___.
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为___mg•L-1.在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果___(填“偏高”“偏低”或“不变”).
【实验一】Na2S2O3•5H2O的制备
Ⅰ实验原理:Na2SO3(aq)+S(s)
| ||
Ⅱ实验装置:如图1所示,有关物质的溶解度曲线如图2所示:

Ⅲ实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是___,装置 C中的硫粉应事先研细并用乙醇润湿,否则会影响___.
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式:___.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热.采取该措施的理由是___.
(4)将C中的混合液过滤,将滤液经过___、___、过滤、洗涤、烘干,可得粗产品Na2S2O3•5H2O.
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:___.
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯.测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯.再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积.
(已知:滴定时反应的化学方程式为I2+2Na2SO3═2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为___.
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为___mg•L-1.在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果___(填“偏高”“偏低”或“不变”).
▼优质解答
答案和解析
(1)B和D是为了吸收多余的二氧化硫,所以装的是NaOH溶液;把硫研细,增大接触面积,加快反应速率,S微溶于酒精,所以C中的硫粉应事先研细并用乙醇润湿,否则会降低反应速率,
故答案为:NaOH溶液;降低反应速率;
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内生成二氧化硫气体,发生反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解,
故答案为:防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O,不能直接蒸干,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干等操作,
故答案为:蒸发浓缩;冷却结晶;
(5)检验样品中是否含有硫酸钠的方案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子,反应离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(7)根据Cl2~I2~2Na2S2O3,可知n(Cl2)=
n(Na2S2O3)=
×V×10-3L×Cmol/L,氯气质量为=
×V×10-3L×Cmol/L×71g/mol=3.55VC×10-2g=35.5VC mg,故余氯量(以游离Cl2计算)为
=355VC mg/L;
动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大,所以结果偏高,
故答案为:355VC;偏高.
故答案为:NaOH溶液;降低反应速率;
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内生成二氧化硫气体,发生反应的化学方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(3)SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解,
故答案为:防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O,不能直接蒸干,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干等操作,
故答案为:蒸发浓缩;冷却结晶;
(5)检验样品中是否含有硫酸钠的方案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子,反应离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(7)根据Cl2~I2~2Na2S2O3,可知n(Cl2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 35.5VCmg |
| 0.1L |
动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大,所以结果偏高,
故答案为:355VC;偏高.
看了 Na2S2O3可做分析试剂....的网友还看了以下:
Na2SO3和Na2SO4分别是什么物质?有什么差别呢?2NaOH+SO2===Na2SO3+H2 2020-05-12 …
Na2SO3+KMnO4(H+)方程式 2020-05-17 …
向正在进行有氧呼吸的细胞悬液中分别加入a、b、c、d四种抑制剂,下列说法正确的是()A.若a能抑制 2020-07-08 …
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.H分子中含有1个-CH3, 2020-10-29 …
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.H分子中含有1个-CH3, 2020-10-29 …
如h表示你肠杆菌的D4A复制示意h.如果是单起点单向复制,按正常的子链延伸速度,此D4A分子复制约需 2020-11-28 …
分封制h分封制时继承是家族里传,还是父子相传,还是兄弟相传? 2020-12-12 …
软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线为:已知:a.b.H为甲基丙烯 2020-12-25 …
(2012•眉山模拟)某校化学兴趣小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3 2021-01-22 …
SO2是一种和CO2的性质相似的酸性气体.实验室常用Na2SO3制取,化学方程式为:Na2SO3(固 2021-02-01 …