早教吧作业答案频道 -->化学-->
水体污染的治理是化学工作者研究的重要课题.(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去.已知NH4++HClO═NH2Cl+H++H2O△H=akJ⋅mol-12NH2C
题目详情
水体污染的治理是化学工作者研究的重要课题.
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去.
已知 NH4++HClO═NH2Cl+H++H2O△H=a kJ⋅mol-1
2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ⋅mol-1
NH4++4HClO═NO3-+6H++4Cl-+H2O△H=c kJ⋅mol-1
则 2NH4++3HClO═N2+3H2O+5H++3Cl-△H=___kJ⋅mol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟.
①电解时,阳极的电极反应式为___.电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示.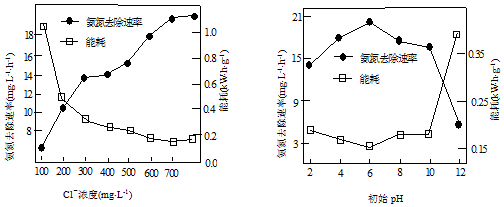
②图1中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是___;而当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是___.
③图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是___.
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去.写出该反应的离子方程式:___.
(4)废水中的重金属离子通常用沉淀法除去.已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol•L-1,铜低于7.8×10-5mol•L-1.则需要控制溶液中S2-的浓度不低于___mol•L-1.
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去.
已知 NH4++HClO═NH2Cl+H++H2O△H=a kJ⋅mol-1
2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ⋅mol-1
NH4++4HClO═NO3-+6H++4Cl-+H2O△H=c kJ⋅mol-1
则 2NH4++3HClO═N2+3H2O+5H++3Cl-△H=___kJ⋅mol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟.
①电解时,阳极的电极反应式为___.电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示.

②图1中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是___;而当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是___.
③图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是___.
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去.写出该反应的离子方程式:___.
(4)废水中的重金属离子通常用沉淀法除去.已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol•L-1,铜低于7.8×10-5mol•L-1.则需要控制溶液中S2-的浓度不低于___mol•L-1.
▼优质解答
答案和解析
(1))①NH4++HClO═NH2Cl+H++H2O△H=a kJ⋅mol-1
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ⋅mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ⋅mol-1;
故答案为:2a+b;
(2)①阳极失去电子发生氧化反应,故电极反应方程式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
②氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是:Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH
氧化为NO
,
故答案为:阳极可能OH-放电,产生大量氧气,消耗电能;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH
氧化为NO
;
③当pH过低时,处理效果不佳的原因可能是,pH太低时,产生的Cl2会从溶液中逸出,
故答案为:pH太低时,产生的Cl2会从溶液中逸出;
(3)漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O,
故答案为:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O;
(4)Ksp(NiS)=c(Ni+)c(S2-)=1.1×10-21,则c(S2-)=
=
=10-16mol•L-1,Ksp(CuS)=c(Cu2+)c(S2-)
=1.3×10-36,c(S2-)=
=
=1.7×10-32mol•L-1,1.7×10-32mol•L-1<10-16mol•L-1,故则需要控制溶液中S2-的浓度不低于10-16mol•L-1,
故答案为:10-16.
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ⋅mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ⋅mol-1;
故答案为:2a+b;
(2)①阳极失去电子发生氧化反应,故电极反应方程式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
②氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是:Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH
+ 4 |
- 3 |
故答案为:阳极可能OH-放电,产生大量氧气,消耗电能;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH
+ 4 |
- 3 |
③当pH过低时,处理效果不佳的原因可能是,pH太低时,产生的Cl2会从溶液中逸出,
故答案为:pH太低时,产生的Cl2会从溶液中逸出;
(3)漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O,
故答案为:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O;
(4)Ksp(NiS)=c(Ni+)c(S2-)=1.1×10-21,则c(S2-)=
| Ksp(NiS) |
| c(Ni+) |
| 1.1×10-21 |
| 1.1×10-5 |
=1.3×10-36,c(S2-)=
| Ksp(CuS) |
| c(Cu2+) |
| 1.3×10-36 |
| 7.8×10-5 |
故答案为:10-16.
看了 水体污染的治理是化学工作者研...的网友还看了以下:
一道初二数学有关n的H运算求教规定规定正整数n的H运算是:(1)当n为奇数时,H=3n+13;(2 2020-05-14 …
积累与运用(共30分)根据拼音在田字格内写出相应的汉字。(4分)今年是红军长征开始80周年。当年, 2020-05-15 …
请教catalan数网上对catalan数的通项有两种说法一种说catalan数满足递归式:h(n 2020-06-28 …
给加点的字注音或根据拼音写汉字。①白雪áiái②故弄xuán虚③琐屑④péngpài⑤hān然入梦 2020-07-27 …
注音或填字:①云yá②白雪皑皑③hān然入梦④呜咽⑤蔫巴⑥落得很远⑦焦zhuó⑧万lài俱寂。 2020-07-27 …
求幂函数f(x)=x^n的导数△y=(x+h)^n-x^n为什么会等于={x^n+n*x^(n-1) 2020-11-01 …
选出下面各项中字音有误的一项:A强横hèng哄堂大笑hōng哄骗hǒng踽踽独行yǔB內讧hòng邂 2020-11-07 …
(4分)根据拼音写出相应的汉字。屋外,是皑皑的雪。我仍zhǎn转反侧,不能入眠。我在静谧的夜里,默默 2020-11-27 …
根据拼音在田字格内依次写出相应的汉字。在华北平原广阔的土地上,你偶尔会碰到那样的村子,它们wō居在大 2020-12-15 …
下列各组词语中读音和书写有错误的一项是(3分)A.脍(kuài)炙人口斟(zhēn酌B.重峦叠障(z 2021-01-14 …