早教吧作业答案频道 -->化学-->
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为.
题目详情
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为___.
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点.以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
则a为___.
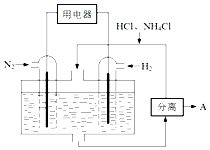
(3)如图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式___.生产中可分离出的物质A的化学式为___.
(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3•H2O):c(NH4+)=5:9,此时溶液的
pH=___.(25℃时,NH3•H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟严肃的质量分数为79.17%.请写出SiO2溶于氢氟酸的离子方程式___.

(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为___.
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点.以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
则a为___.
(3)如图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式___.生产中可分离出的物质A的化学式为___.
(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3•H2O):c(NH4+)=5:9,此时溶液的
pH=___.(25℃时,NH3•H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟严肃的质量分数为79.17%.请写出SiO2溶于氢氟酸的离子方程式___.
▼优质解答
答案和解析
(1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若6molH3PO4生成,则参加反应CuSO4为6mol×
=15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为
=0.75mol,
故答案为:0.75mol;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
依据热化学方程式和盖斯定律①+②=③,得到-159.47KJ/mol+a=-86.98KJ/mol
a=+72.49KJ/mol;
故答案为:+72.49;
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液中可以分离出氯化铵;
故答案为:N2+6e-+8H+=2NH4+; NH4Cl;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和0.1水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3•H2O⇌NH4++OH-,25℃时.NH3•H2O的电离平衡常数Kb=1.8×10-5=
,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,PH=9,
故答案为:9;
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有
×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6,故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62-+2H2O,故答案为:SiO2+6HF=2H++SiF62-+2H2O.
| 60 |
| 24 |
| 15mol×1 |
| 4×5 |
故答案为:0.75mol;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
依据热化学方程式和盖斯定律①+②=③,得到-159.47KJ/mol+a=-86.98KJ/mol
a=+72.49KJ/mol;
故答案为:+72.49;
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液中可以分离出氯化铵;
故答案为:N2+6e-+8H+=2NH4+; NH4Cl;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和0.1水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3•H2O⇌NH4++OH-,25℃时.NH3•H2O的电离平衡常数Kb=1.8×10-5=
c(OH-)×
| ||
|
故答案为:9;
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有
| 19y |
| 2+28x+19y |
看了 氮及其化合物在工农业生产生活...的网友还看了以下:
向社会征求意见已经成为决策机关决策时的“规定动作”。这一“规定动作”的落实()①消解了决策复杂性② 2020-05-17 …
python的问题L=[1,2,3,4]whileL:front,L=L[0],L[1:]prin 2020-06-12 …
用石墨电极电解1mol*L-1的CUSO4溶液,当C(CU2+为0.5)用石墨作电极电解1L1mo 2020-06-27 …
反应Ⅱ:2H2SO4(l)===2SO2(g)+O2+2H2O(g)ΔH=+550kJ·mol-1 2020-07-18 …
阅读下文,完成l~4题。楚、汉久相持未决,丁壮苦军旅,老弱罢转漕①。项王谓汉王曰:“天下匈匈数岁者 2020-07-28 …
阅读下文,完成l~4题。楚、汉久相持未决,丁壮苦军旅,老弱罢转漕①。项王谓汉王曰:“天下匈匈数岁者 2020-07-28 …
一个L和R串联电路,闭合开关后,L亮一段时间后熄灭,找相同规格和完好的L1代替L,答案是若L亮则L一 2020-11-27 …
今年L市鲜蛋的产量预计在1.5亿千克左右,而禽蛋公司合同购数才9000万千克。目前,。禽蛋公司鸡蛋大 2020-12-10 …
研究发现豚鼠血清对人淋巴瘤细胞有抑制作用,而对正常细胞无影响.进一步研究发现,发挥作用的物质是L-天 2020-12-24 …
用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:(1)应取浓硫 2021-01-22 …