早教吧作业答案频道 -->化学-->
(1)已知H-H键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是(2)事实证明,能设计成原电池的反应通常是放热反
题目详情
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是___
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___.
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)═2H2O(1)△H<0
C.NaOH(aq)+HC1(aq)=“NaC1(aq)“+H2O(1)△H<0
(3)以KOH溶液为电解质溶液,依据(2)所选反应设计一个原电池,其正极的电极反应式___.
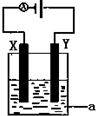
(4)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为___.
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=___(假设电解后溶液体积不变).
③若用此电解装置模拟工业精炼铜,则应将a改为___溶液,并将___极换成粗铜(填“X”或“Y”)
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___.
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)═2H2O(1)△H<0
C.NaOH(aq)+HC1(aq)=“NaC1(aq)“+H2O(1)△H<0
(3)以KOH溶液为电解质溶液,依据(2)所选反应设计一个原电池,其正极的电极反应式___.
(4)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为___.
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=___(假设电解后溶液体积不变).
③若用此电解装置模拟工业精炼铜,则应将a改为___溶液,并将___极换成粗铜(填“X”或“Y”)

▼优质解答
答案和解析
(1)已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=945.6 kJ/mol,故答案为:945.6 kJ/mol;
(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,
A.该反应是吸热反应,所以不能设计成原电池,故不选;
B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;
C.该反应不是氧化还原反应,所以不能设计成原电池,故不选;
故选:B;
(3)以KOH溶液为电解质溶液的氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+
=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=
=0.1mol/L,所以溶液的pH=1,故答案为:1;
③工业精炼铜时,阳极是粗铜,电解液为含铜离子的溶液CuSO4或CuCl2,故答案为:CuSO4或CuCl2;Y.
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=945.6 kJ/mol,故答案为:945.6 kJ/mol;
(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,
A.该反应是吸热反应,所以不能设计成原电池,故不选;
B.该反应是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;
C.该反应不是氧化还原反应,所以不能设计成原电池,故不选;
故选:B;
(3)以KOH溶液为电解质溶液的氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O
| ||
| ||
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
| 0.04mol |
| 2 |
| 0.224L |
| 22.4L/mol |
| ||
| 0.4L |
③工业精炼铜时,阳极是粗铜,电解液为含铜离子的溶液CuSO4或CuCl2,故答案为:CuSO4或CuCl2;Y.
看了 (1)已知H-H键能为436...的网友还看了以下:
数学题已知数列-1,1/4,-1/9,…,(-1)n.1/n2,…,已知数列-1,1/4,-1/9, 2020-03-30 …
已知数列{an}的前n项和Sn=2n−1,n≤4−n2+(a−1)n,n≥5.n∈N*,则an=2 2020-04-07 …
在2L密闭容器中加入适量的氮气和氢气,发生反应N2(g)+3H2(g)⇌2NH3(g),10min 2020-05-13 …
数列{ an } 中,a1 =1,对于所有的n≥2,n∈ N* 都有 a1 × a2 ×a3×…… 2020-05-16 …
已知抛物线y=x2-2x-m与x轴有两个不同的交点.(1)求m的取值范围;(2)如果A(n-1,n 2020-05-16 …
4道数学难题1:分解因式:X的平方-5X-6=(X+M)(X+N).求m+n2:把函数关系式的直线 2020-05-17 …
整数划分问题将以正整数n表示成一系列正整数之和.n=n1+n2+n3+...+nk(n1>=n2> 2020-05-20 …
如图,第n个图形是由正n+2边形“扩展”而来,(n=1,2,3,…),则第n-2个图形中共有()个 2020-06-03 …
数学(初一的第一学期)1.已知N的平方=a的四次方b的四次方,2.(2的平方)的n次方+(2的n次 2020-06-03 …
1、已知25^m*2*10^n=5^7*2^4,求m、n2、已知9^n+1-3^2n=72,求n的 2020-06-06 …