早教吧作业答案频道 -->化学-->
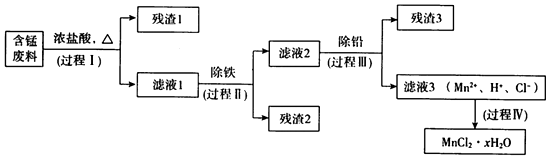
以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2•xH2O,实现锰的再生利用.其工作流程如图:资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下
题目详情
以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2•xH2O,实现锰的再生利用.其工作流程如图:
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化.
资料b:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-l
(1)过程I的目的是浸出锰.经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+.
①MnO2与浓盐酸反应的离子方程式是___.
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,___.
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c.…
写出c的离子方程式:___.
(2)过程Ⅱ的目的是除铁.有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤.
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物…
已知:焙烧中发生的主要反应为2FeCl3+3O2
2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化.
①氨水法除铁时,溶液pH应控制在___之间.
②补全ii中的操作:___.
③两种方法比较,氨水法除铁的缺点是___.
(3)过程Ⅲ的目的是除铅.加入的试剂是___.
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g.则x=___.

资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化.
资料b:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰.经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+.
①MnO2与浓盐酸反应的离子方程式是___.
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,___.
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=4Fe3++2H2O
c.…
写出c的离子方程式:___.
(2)过程Ⅱ的目的是除铁.有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤.
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物…
已知:焙烧中发生的主要反应为2FeCl3+3O2
| ||
①氨水法除铁时,溶液pH应控制在___之间.
②补全ii中的操作:___.
③两种方法比较,氨水法除铁的缺点是___.
(3)过程Ⅲ的目的是除铅.加入的试剂是___.
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g.则x=___.
▼优质解答
答案和解析
(1)①浓盐酸与二氧化锰反应产生氯气,反应为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
②铁离子使KSCN溶液显红色,检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红;
故答案为:再滴加KSCN溶液,溶液变红;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
故答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2)①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,故pH应小于6.5;
故答案为:3.2~6.5;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
故答案为:加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水发除铁,除铁过程中,引入杂质NH4+;
故答案为:引入杂质NH4+;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质;
故答案为:锰;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则n(MnCl2)=
nol,结晶水的质量为(m1-m2)g,n(H2O)=
,则1:x=n(MnCl2):n(H2O),解得x=
;
故答案为:
.
| ||
故答案为:MnO2+4H++2Cl-
| ||
②铁离子使KSCN溶液显红色,检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红;
故答案为:再滴加KSCN溶液,溶液变红;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
故答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2)①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,故pH应小于6.5;
故答案为:3.2~6.5;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于6.5;
故答案为:加水溶解,过滤,再加盐酸酸化至pH小于6.5;
③氨水发除铁,除铁过程中,引入杂质NH4+;
故答案为:引入杂质NH4+;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质;
故答案为:锰;
(4)m1gMnCl2•xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则n(MnCl2)=
| m2 |
| 131 |
| m1-m2 |
| 18 |
| 7(m1-m2) |
| m2 |
故答案为:
| 7(m1-m2) |
| m2 |
看了 以废旧锌锰电池初步处理分选出...的网友还看了以下:
丙酸的结构为CH3—CH2—COOH丙酸盐是安全有效的防霉、防腐剂一种以碱式碳酸锌为原料的生产工艺 2020-04-07 …
(72~73题共用备选答案)A.皮肤活检发现皮下组织大量嗜酸细胞浸润B.肾活检发现肾小球IsA免疫复 2020-06-04 …
解释生活中的现象:(1)活性炭净水原理是.(2)用水灭火原理.(3)如果用硬水和肥皂洗衣服,会出现 2020-06-14 …
“生活处处有物理”.下列生活中出现的现象与物理知识对应正确的是()A.打开醋瓶能闻到酸味--分子间 2020-07-10 …
0.02N的硫酸是指什么?现在要用98%的硫酸配成0.02N的硫酸,N指的浓度吗?98%的硫酸中1 2020-07-17 …
已知流感病毒只含有一种核酸,现欲探究甲型H1N1流感病毒的核酸是DNA还是RNA.材料用具:显微注 2020-07-25 …
这就是生活指出下面句子中“这”所指代的内容.1这就是生活,酸甜苦辣,这就是生活指出下面句子中“这”所 2020-10-30 …
谁会这道题:酸雨是一种大气污染现酸雨是一种大气污染现象,长江沿江地带酸雨现象严重,其中污染范围最大、 2020-11-24 …
氧气是一种化学性质比较活泼n气体,它可以和许多物质发生化学反应.(u)小明是个善于思考、善于总结n学 2020-11-29 …
下列分别属于脱氨基和氨基转换作用的实例是()①苏氨酸丁酮酸+NH3②谷氨酸氨基丁酸+CO2③谷氨 2021-01-22 …