常温下,向20mL0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是()A.当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(
常温下,向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )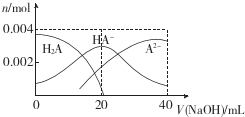
A. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c( A2-)>c( OH-)>((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH)=40 mL时,升高温度,
减小c(Na+) c(A2-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,得到NaHA的溶液,由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,故B错误;
C.等浓度H2A和NaHA的混合溶液形成缓冲溶液,溶液中存在电离平衡H2A⇌H++HA-,水解平衡 NaHA+H2O⇌NaOH+H2A,加入酸HA-会消耗氢离子生成H2A,加入碱会和酸H2A反应生NaHA,阻碍溶液PH的变化,所以无论加入少量的强酸或强碱,溶液的pH变化都不大,故C正确;
D.向20mL 0.2mol.L-1二元酸H2A溶液中滴加0.2mol.L-lNaOH溶液40ml,反应后得到溶液为Na2A溶液,A2-离子水解溶液显碱性,加热促进水解A2-离子浓度减小,钠离子浓度不变,则比值增大,故D错误;
故选C.
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,对人体健康及大 2020-05-13 …
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,也称为可入肺颗 2020-05-13 …
PM2.5是指大气中直径小于或等于2.5μm(1μm=0.000001m)的颗粒物,也称为可入肺颗 2020-05-13 …
1.宇宙飞船在飞行过程中有很多技术问题需要解决,其中之一就是当飞船进入宇宙微粒尘区时如何保持速度不 2020-06-23 …
酸、碱、盐溶解性表是学习化学的重要工具.你表列出m“部分酸、碱、盐在40℃时的溶解性.”O0ˉNO 2020-07-11 …
求助高人解一道在法国遇到的物化题~我就直译了,法语不是很好.在18摄氏度,溶液的总体积由1000,0 2020-11-05 …
Mg-Al合金mg,完全溶于足量盐酸,得到标准状况下H2的体积为2.24L,现向反映后溶液加入足量氨 2020-11-27 …
298k时电解含有FeCl2(m=0.01mol·kg-1)和CuCl2(m=0.02mol·kg- 2020-12-02 …
matlab模拟带电粒子在均匀电磁场中的运动functionydot=ddlzfun(t,y,fla 2020-12-14 …
如图所示,在直角坐标系xOy中,点M(0,1)处不断向+y方向发射出大量质量为m、带电荷量为-q的粒 2020-12-18 …