早教吧作业答案频道 -->化学-->
含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用.利用Cu2O光催化可以处理含有Cr2O72-的废水.Ⅰ.制取Cu2O(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反
题目详情
含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用.利用Cu2O光催化可以处理含有Cr2O72-的废水.
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计).
①阳极材料是___.
②阴极的电极反应式是;电解总反应为:___.
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为___.
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体.反应过程中需要不断地加入烧碱,其原因是___.
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究.
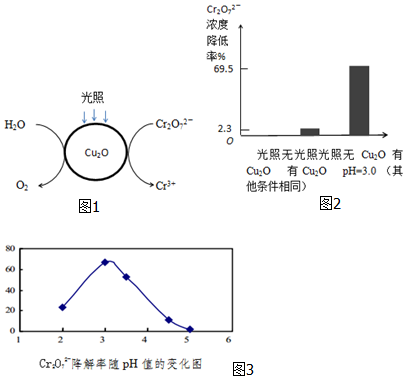
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示.在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应.
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应.
已知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如图2所示.结合试剂用量数据和实验结果可得到的结论和依据是___.
(3)溶液的pH对Cr2O72-降解率的影响如3图所示.
已知:Cu2OCu+CuSO4;酸性越大,Cr2O72-被还原率越大.
①由图3可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是___,其原因是___.
②已知pH=5时,会产生Cr(OH)3沉淀.pH=5时,Cr2O72-的降解率低的原因是___.
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计).
①阳极材料是___.
②阴极的电极反应式是;电解总反应为:___.
(2)还原法
①工业上可用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为___.
②控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体.反应过程中需要不断地加入烧碱,其原因是___.
Ⅱ.利用Cu2O光催化处理含有Cr2O72-的废水的研究.
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示.在图中用短线和箭头画出电子移动的方向,写出Cr2O72-转化Cr3+的电极反应.
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O 与Cr2O72-发生氧化还原反应.
已知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如图2所示.结合试剂用量数据和实验结果可得到的结论和依据是___.
(3)溶液的pH对Cr2O72-降解率的影响如3图所示.
已知:Cu2OCu+CuSO4;酸性越大,Cr2O72-被还原率越大.
①由图3可知,pH分别为2、3、4时,Cr2O72-的降解率最好的是___,其原因是___.
②已知pH=5时,会产生Cr(OH)3沉淀.pH=5时,Cr2O72-的降解率低的原因是___.

▼优质解答
答案和解析
Ⅰ、(1)①反应只消耗了铜和水,说明铜在阳极放电,所以阳极材料是铜,故答案为:Cu;
②反阴极发生还原反应,阴极的电极反应式是2H2O+2e-=H2↑+2OH-;电解总反应为:2Cu+H2O
H2↑+Cu2O,故答案为:2H2O+2e-=H2↑+2OH-;2Cu+H2O
H2↑+Cu2O;
(2)①根据反应物N2H4和Cu(OH)2,生成物是Cu20、H2O和N2,可得化学方程式为4Cu(OH)2+N2H4
N2↑+2Cu2O+6H2O,故答案为:4Cu(OH)2+N2H4
N2↑+2Cu2O+6H2O;
②亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体,反应方程式为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,随反应的不断进行溶液的PH不断下降,所以加入氢氧化钠是调节溶液的PH的,故答案为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱;
Ⅱ.(1)负极是水中-2价的氧失电子,而正极Cr2O72-转化Cr3+,电子的转移方向为: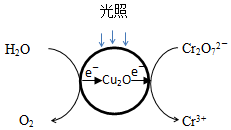 ,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为:
,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为: ;Cr2O72-+14H++6e-=2Cr3++7H2O;
;Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)若发生氧化还原反应,则存在比例:3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在,故答案为:Cu2O作光催化剂;3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①由图可知:pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,故答案为:pH=3;pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;
②pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面,故答案为:pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行.
②反阴极发生还原反应,阴极的电极反应式是2H2O+2e-=H2↑+2OH-;电解总反应为:2Cu+H2O
| ||
| ||
(2)①根据反应物N2H4和Cu(OH)2,生成物是Cu20、H2O和N2,可得化学方程式为4Cu(OH)2+N2H4
| ||
| ||
②亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体,反应方程式为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4,随反应的不断进行溶液的PH不断下降,所以加入氢氧化钠是调节溶液的PH的,故答案为:2CuSO4+3Na2SO3=Cu2O+2SO2↑+3Na2SO4反应过程中溶液的酸性不断地增强,为调节pH所以需要加入烧碱;
Ⅱ.(1)负极是水中-2价的氧失电子,而正极Cr2O72-转化Cr3+,电子的转移方向为:
 ,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为:
,Cr2O72-转化Cr3+的电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为: ;Cr2O72-+14H++6e-=2Cr3++7H2O;
;Cr2O72-+14H++6e-=2Cr3++7H2O;(2)若发生氧化还原反应,则存在比例:3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在,故答案为:Cu2O作光催化剂;3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①由图可知:pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,故答案为:pH=3;pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;
②pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面,故答案为:pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行.
看了 含铬(Ⅵ)废水能诱发致癌,对...的网友还看了以下:
可用如图装置制取(必要时可加热)、净化、收集的气体是()A.铜和稀硝酸制一氧化氮B.氯化钠与浓硫酸 2020-05-14 …
下列反应属于氮的固定作用的是()A.N2和H2一定条件下反应制取NH3B.硝酸工厂用NH3氧化制取 2020-05-14 …
随着认识风险、抵御风险的能力不断增强,人类可以在一定程度上降低风险的危害程度,有效控制和化解 2020-05-22 …
目前,我国银行信贷管理一般实行( )相结合制度,以切实防范、控制和化解贷款业务风险。 2020-05-30 …
银行信贷管理实行集中授权管理,以切实防范、控制和化解贷款业务风险。实行集中授权管理是 2020-06-27 …
中国瓷器烧制和化学有什么关系 2020-06-29 …
氯化钠,可月于制造纯碱和烧碱及其6化工产品,食品工业和渔业用于盐腌,.还可用作调味料的原料和精制食 2020-07-24 …
按要求写出化学方程式.(1)过氧化氢溶液实验室制氧气;(2)用盐酸来除铁制品表面的锈;(3)氧化铝是 2020-11-02 …
如图为家庭制氧机内桶构造示意图,桶上设有制氧剂投药口和出气口.已知:i.制氧剂的主要成分是过碳酸钠和 2020-11-20 …
古希腊民主制的特征可以概括为人民主权、轮番而治。体现这两项内容的制度包括公民大会制和A.举手表决制、 2020-11-29 …