早教吧作业答案频道 -->化学-->
已知:Al(OH)3沉淀可溶于NaOH溶液,其反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O现向100gHCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关
题目详情
已知:Al(OH)3沉淀可溶于NaOH溶液,其反应的化学方程式为:
Al(OH)3+NaOH═NaAlO2+2H2O
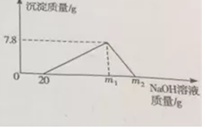
现向100gHCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示.回答下列问题:
(1)原混合溶液中HCl的质量分数是___.
(2)当沉淀到达最大值时生成NaCl的质量是多少?(列式计算)
(3)m2=___.

Al(OH)3+NaOH═NaAlO2+2H2O
现向100gHCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示.回答下列问题:
(1)原混合溶液中HCl的质量分数是___.
(2)当沉淀到达最大值时生成NaCl的质量是多少?(列式计算)
(3)m2=___.
▼优质解答
答案和解析
(1)由图可以看出和盐酸反应的氢氧化钠溶液的质量为20g,所含溶质的质量为20g×20%=4g
设HCl的质量为x,生成的氯化钠的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
x 4g y
=
=
x=3.65g
y=5.85g
原混合溶液中HCl的质量分数为
×100%=3.65%
设生成7.8g氢氧化铝所消耗的NaOH的质量为z,生成的氯化钠的质量为a
AlCl3+3NaOH=Al(OH)3↓+3NaCl
120 78 175.5
z 7.8g a
=
=
z=12g
a=17.55g
沉淀达到最大量时生成的氯化钠的质量为5.85g+17.55g=23.4g.
(3)设7.8g氢氧化铝完全转化为偏铝酸钠需要的氢氧化钠的质量为m
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
7.8g m
=
m=4g
所消耗的氢氧化钠的总质量为4g+12g+4g=20g
所对应的溶液的质量为20g÷20%=100g
即m2=100.
答:(1)原混合溶液中HCl的质量分数是 3.65%.
(2)当沉淀到达最大值时生成NaCl的质量是23.4g.
(3)m2=100.
(1)由图可以看出和盐酸反应的氢氧化钠溶液的质量为20g,所含溶质的质量为20g×20%=4g
设HCl的质量为x,生成的氯化钠的质量为y
HCl+NaOH=NaCl+H2O
36.5 40 58.5
x 4g y
| 36.5 |
| x |
| 40 |
| 4g |
| 58.5 |
| y |
x=3.65g
y=5.85g
原混合溶液中HCl的质量分数为
| 3.65g |
| 100g |
设生成7.8g氢氧化铝所消耗的NaOH的质量为z,生成的氯化钠的质量为a
AlCl3+3NaOH=Al(OH)3↓+3NaCl
120 78 175.5
z 7.8g a
| 120 |
| z |
| 78 |
| 7.8g |
| 175.5 |
| a |
z=12g
a=17.55g
沉淀达到最大量时生成的氯化钠的质量为5.85g+17.55g=23.4g.
(3)设7.8g氢氧化铝完全转化为偏铝酸钠需要的氢氧化钠的质量为m
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
7.8g m
| 78 |
| 40 |
| 7.8g |
| m |
m=4g
所消耗的氢氧化钠的总质量为4g+12g+4g=20g
所对应的溶液的质量为20g÷20%=100g
即m2=100.
答:(1)原混合溶液中HCl的质量分数是 3.65%.
(2)当沉淀到达最大值时生成NaCl的质量是23.4g.
(3)m2=100.
看了 已知:Al(OH)3沉淀可溶...的网友还看了以下:
已知如图,四边形EFGH的顶点E,F,G,H分别在正方形ABCD的边AB,BC,CD,DA上,且A 2020-05-16 …
在棱长为2的正方体ABCD-A1B1C1D1中,E,F,G,H分别为BC,CD,CC1,C1D1的 2020-05-16 …
H+与CO32-反应,H+少量,H+过量,2个离子方程怎么写?羧基与酚羟基,哪个先与CO32-反应 2020-05-23 …
变限积分求道问题对函数f(t+h)-f(t-h)在[-h,h]上的积分对h求导.F(h)=∫[-h 2020-05-23 …
变限积分[a,b]上的积分∫[f(x+h)-f(x)]dx令x+h=t,那原式=∫[a+h,b+h 2020-07-11 …
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是()A.向水中加入稀醋 2020-07-11 …
如图,在边长为1正方形ABCD中,E、F、G、H分别是AB、BC、CD、DA上的点,3AE=EB, 2020-07-22 …
在边长为1的正方形ABCd中,E,F,G,H分别落在AB,BC,CD,DA上(且不与顶点重合)有一 2020-07-22 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
长方形ABCD中,E、G和F、H分别是DC与AB的三等分点,沿EF、GH将其折成一个无底三棱柱,则 2020-08-02 …