常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是()A.V=40B.C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )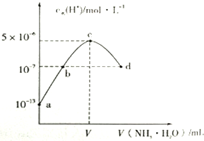
A. V=40
B. C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O)
C. NH3.H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)═2c(SO42-)
B.c点所示溶液是硫酸铵溶液,溶液中质子守恒:c(H+)=c(NH3.H2O)+c(OH-),所以溶液中存在:c(H+)-c(OH-)=c(NH3.H2O),故B错误;
C.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=
| 10-14 |
| 10-11 |
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
| 10-3×10-3 |
| 0.1 |
D.根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH4+)=2c(SO42-),故D正确;
故选D.
下列过程与配合物的形成无关的是()A.除去Fe粉中的SiO2可用于强碱溶液B.向一定量的AgNO3 2020-05-13 …
下列过程与配合物的形成无关的是()A.向一定量的AgNO3溶液中加入氨水至沉淀消失B.向FeCl3 2020-05-13 …
下列过程与配合物的形成无关的是()A.除去Fe粉中的SiO2可用于强碱溶液B.向一定量的AgNO3 2020-05-13 …
离子反应方程式书写基础训练1.写出下列离子方程式.写出下列离子方程式(1)氨气通入稀硫酸溶液中(2 2020-05-17 …
求二氧化硫通入氨水制化肥的方程式.O(∩∩)O~这个化肥是什么啊 2020-07-13 …
1,氯化铵溶液和氢氧化钠溶液混合可不可以置氨气,为什么2,浓氨水中加入固体氢氧化钠并加热可不可以质 2020-07-22 …
硫酸铜溶液中加入氨水生成沉淀然后再加入氨水直到沉淀刚好溶解然后再加入硫酸铜溶液后又有沉淀生成.为.. 2020-11-04 …
(2012•怀化二模)Ⅰ、在饱和食盐水中先通入氨气进行氨化,再通入二氧化碳,可制得小苏打.在析出小苏 2020-11-12 …
下列各表述与示意图不一致的是()A.图①表示25℃时,向盐酸和醋酸混合溶液中滴入氨水过程中电导率(表 2020-11-29 …
以化学平衡移动原理为依据,解释以下事实:(1)在氨水中加入氢氧化钠固体,有氨气逸出。(2)合成氨工业 2020-12-01 …