早教吧作业答案频道 -->化学-->
无水氯化铝在生产、生活中应用广泛.(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为.(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取
题目详情
无水氯化铝在生产、生活中应用广泛.
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
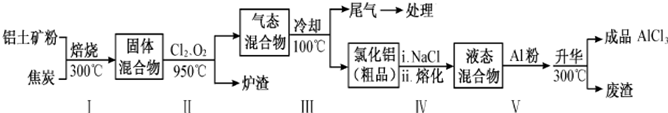
已知:
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___(只要求写出一种).
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是___.
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为___.
④步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为___、___、___.
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___.
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是___.
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为___.
④步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为___、___、___.
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___.
▼优质解答
答案和解析
(1)氯化铝是强酸弱碱盐,在溶液中铝离子发生水解反应产生氢氧化铝胶体,胶体具有吸附性,所以能净水,其反应的离子方程式为:Al3++3H2O⇌Al(OH)3+3H+,
故答案为:Al3++3H2O⇌Al(OH)3+3H+;
(2)①步骤1中铝土矿粉和焦炭在300℃焙烧,因后续步骤反应生成氯化铝等强酸弱碱盐易水解,固体水分在焙烧的过程中挥发,防止后续步骤生成的盐水解、气孔数目增多增大反应物的接触面积,加快反应速率,
故答案为:防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率;
②根据物质中含有的元素组成可知:若步骤Ⅱ中不通入氯气和氧气,Fe2O3与焦炭发生氧化还原反应,则反应生成相对原子质量比硅大的单质是铁,
故答案为:Fe或铁;
③Ⅰ、Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
Ⅱ、2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
根据盖斯定律,将Ⅰ-Ⅱ可得:Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=(+1344.1kJ•mol-1)-(+1169.2kJ•mol-1)=+174.9KJ/mol,
故答案为:Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=+174.9KJ/mol;
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,Cl2和NaOH溶液反应生成NaCl、NaClO和H2O,CO2和NaOH溶液反应生成Na2CO3和H2O,所以生成的盐的化学式为NaCl、NaClO和Na2CO3,
故答案为:NaCl、NaClO、Na2CO3;
⑤步骤Ⅲ得到氯化铝的粗品,加入氯化钠熔融能降低FeCl3的熔点,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,因AlCl3在180℃升华,在300℃,废渣为Fe,冷却得到成品氯化铝,
故答案为:除去FeCl3,提高AlCl3纯度.
故答案为:Al3++3H2O⇌Al(OH)3+3H+;
(2)①步骤1中铝土矿粉和焦炭在300℃焙烧,因后续步骤反应生成氯化铝等强酸弱碱盐易水解,固体水分在焙烧的过程中挥发,防止后续步骤生成的盐水解、气孔数目增多增大反应物的接触面积,加快反应速率,
故答案为:防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率;
②根据物质中含有的元素组成可知:若步骤Ⅱ中不通入氯气和氧气,Fe2O3与焦炭发生氧化还原反应,则反应生成相对原子质量比硅大的单质是铁,
故答案为:Fe或铁;
③Ⅰ、Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
Ⅱ、2AlCl3(g)=2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
根据盖斯定律,将Ⅰ-Ⅱ可得:Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=(+1344.1kJ•mol-1)-(+1169.2kJ•mol-1)=+174.9KJ/mol,
故答案为:Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g))+3CO(g)△H=+174.9KJ/mol;
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,Cl2和NaOH溶液反应生成NaCl、NaClO和H2O,CO2和NaOH溶液反应生成Na2CO3和H2O,所以生成的盐的化学式为NaCl、NaClO和Na2CO3,
故答案为:NaCl、NaClO、Na2CO3;
⑤步骤Ⅲ得到氯化铝的粗品,加入氯化钠熔融能降低FeCl3的熔点,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,因AlCl3在180℃升华,在300℃,废渣为Fe,冷却得到成品氯化铝,
故答案为:除去FeCl3,提高AlCl3纯度.
看了 无水氯化铝在生产、生活中应用...的网友还看了以下:
硼氢化钠化学式(NaBH4),是一种安全车载氢源.(l)硼氢化钠中Na、B、H元素的质最比为(最简 2020-07-05 …
金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料.(l)Ti( 2020-07-05 …
如图2是水的电解实验中,对得到气体检验的操作.(l)操作中,盛氧气的试管管口向上,盛氢气的试管管口 2020-07-24 …
酸、碱、盐在生产生活中具有广泛的用途.(l)制作“叶脉书签”需用到10%的氢氧化钠溶液.现配制50 2020-07-26 …
将pH=8的Ba(OH)2溶液与pH=10的NaOH溶液等体积混合,溶液中氢离子浓度最接近于()A 2020-07-27 …
现有2mol/L盐酸和稀硫酸溶液各100mL,分别加入等量的铁粉,反应结束后所生成的氢气体积比为2: 2020-11-05 …
用氢氧化钠固体配成100mL1mol•L-1的NaOH溶液,用托盘天平称取氢氧化钠的质量是()(可能 2021-01-20 …
用氢氧化钠固体配成100mL1mol•L-1的NaOH溶液,用托盘天平称取氢氧化钠的质量是()(可能 2021-01-20 …
化学方程式2H2+O22H2O的正确意义是[]A.氢原子和氧原子在点燃条件下生成水分子B.2份质量的 2021-01-23 …
取16.8g碳酸氢钠固体加热一段时间后,剩余固体质量13.7g,把剩余固体加入到100mL2mol/ 2021-02-09 …