请仔细观察两种电池的构造示意图,回答下列问题:(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:。(2
请仔细观察两种电池的构造示意图,
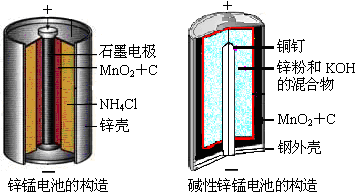
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,
则负极的电极反应式: 。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其可能的原因是 。
(3)原电池可将化学能转化为电能。某课外活动小组设计两种类型的原电池,以 探究其能量转化效率。
限选材料:ZnSO4(aq), CuSO4(aq);铜片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注。
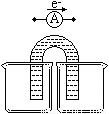
(要求:在同一烧杯中,电极与溶液含相同的金属元素)
②组装原电池乙,要求:以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,(填“甲”或“乙”),其原因是 。
(1)Zn+2OH--2e-=Zn(OH) 2(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大。(3)①
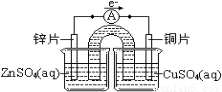
②金属被腐蚀(氧化),表面有红色固体物质生成。
③甲 有盐桥存在时,负极金属与CuSO4(aq)没有直接接触,二者不会发生置换反应,化学能不会转化成热能,几乎全部转化成电能。
分 析:
(1)电池是碱性电池,负极是化合价升高,发生氧化反应,因此Zn作负极,先写出Zn-2e-=Zn(OH)2,再根据反应前后原子个数守恒,配平其他,负极电极反应式:Zn+2OH--2e-=Zn(OH)2;(2)从影响反应速率的因素分析,分析两个电池的结构,锌锰电池负极是锌片,而碱性锌锰电池负极是锌粉,锌粉增加了反应物的接触面积,加快了反应速率,使放电电流大幅度提高;(3)①根据题目所给的装置图,得知:左边烧杯是负极,材料是Zn,右边烧杯是正极才,材料是铜片,左烧杯的盛放的溶液是ZnSO4(aq),右边烧杯是CuSO4(aq),因此装置图为: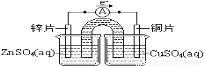 ;
;
②根据原电池的工作原理:锌作负极,Zn-2e-=Zn2+,质量减少,一段时间后锌表面有红色物质生成;③两种原电池原电池甲放电时间较长,因此甲装置更能有效地将化学能转化为电能;有盐桥存在时,负极金属与CuSO4(aq)没有直接接触,二者不会发生置换反应,化学能不会转化成热能,几乎全部转化成电能。
考点:
考查原电池的工作原理。
英语翻译.1那个年轻人整天沉溺于玩乐,什么也不做(abandon).2由于寒冷的天气,那个不幸的弃 2020-05-17 …
1.池塘里有15只鸭子和6只鹅,鹅的只数是鸭子只数的(),鹅的只数比鸭子只数少().2.池塘里有2 2020-05-24 …
1、一个蓄水池有甲、乙两根进水管,当池中无水时,同时打开这两根进水管,3小时进水1/2池,然后关掉 2020-06-23 …
要建造一个容积为1200m^3,深为6m的长方体无盖蓄水池,池壁的造价为95元/m^2,池底的造价 2020-06-23 …
活动二:观察手电筒,同学们首先将后盖旋开观察:电池是怎样安放的?后盖与电池是怎样连接的?后盖的弹簧 2020-06-25 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
说理请你先观察1,2,3三个方框中图形的变化情况,再在A,B,C,D,E,F这六个图形中选一个填入方 2020-11-21 …
请您帮忙翻译,辛苦啦!o(≧v≦)o~~小池塘——春风姐姐轻轻吹了一口气,小池塘就醒来了。池塘里的水 2020-12-15 …
有人在游泳池边上竖直向下观察池水的深度,观察到的池水视深约为h。已知水的折射率为4/3,求池水的实际 2020-12-15 …
电导池两极面积为2.5,两极距离为4,测的电阻为,2池中溶液的电导率为多电导池两极面积为2.5,两极 2021-01-13 …