早教吧作业答案频道 -->化学-->
甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C≡O):①CH3OH
题目详情
甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C≡O):
①CH3OH(g)⇌CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
由此计算△H1=___.已知△H2=-58kJ•mol-1,则△H3=___.
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).
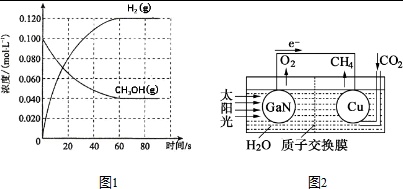
①在0-60s时段,反应速率v(CO)为___;该反应的平衡常数K1 的计算式为___.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2___a1(填“大于”或“小于”、“等于”),判断理由是___.
(3)合成CH4的原理:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式___.
②为提高该人工光合系统的工作效率,可向装置中加入少量___(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___.
①CH3OH(g)⇌CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).

①在0-60s时段,反应速率v(CO)为___;该反应的平衡常数K1 的计算式为___.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2___a1(填“大于”或“小于”、“等于”),判断理由是___.
(3)合成CH4的原理:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式___.
②为提高该人工光合系统的工作效率,可向装置中加入少量___(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___.
▼优质解答
答案和解析
(1)反应热=反应物总键能-生成物总键能,故△H1=(3×413+343+465)kJ•mol-1-1076kJ•mol-1+2×436kJ•mol-1=+99kJ•mol-1;
根据盖斯定律::-反应①-反应②=反应③,故△H3=-△H1-△H2=-99kJ•mol-1-(-58kJ•mol-1)=-41kJ.mol-1,
故答案为:+99kJ•mol-1;-41kJ•mol-1;
(2)①由图象可知,0-60s时段,反应速率v(CH3OH)=
=0.001mol/(L•s),又反应速率之比等于系数之比,所以v(CO)=0.001mol/(L•s),
反应①CH3OH(g)⇌CO(g)+2H2(g)的平衡常数表达式K=
;
故答案为:0.001mol/(L•s);
;
②因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动,则恒压转化率大于恒容,故a2大于a1;故答案为:大于;因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动;
(3)因为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H=-162kJ•mol-1,则该反应为气体体积减小的放热反应,所以升温向逆反应方向进行,加压则向正反应方向进行,而实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,所以Pl>P2;故答案为:>;
(4)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;故答案为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;故答案为:硫酸;
(5)标准状况下,22.4L的甲烷完全燃烧生成的CO2的物质的量为:
=1mol,氢氧化钠的物质的量为:1mol•L-1×0.1L=0.1mol,则二氧化碳过量,反应生成碳酸氢钠,由HCO3-+H2O⇌H2CO3+OH-,HCO3-⇌CO32-+H+和碳酸氢钠溶液成碱性,所以c(CO32-)最小,则c(Na+)最大,因此碳酸氢钠溶液中离子浓度大小顺序为:
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
根据盖斯定律::-反应①-反应②=反应③,故△H3=-△H1-△H2=-99kJ•mol-1-(-58kJ•mol-1)=-41kJ.mol-1,
故答案为:+99kJ•mol-1;-41kJ•mol-1;
(2)①由图象可知,0-60s时段,反应速率v(CH3OH)=
| 0.1-0.04 |
| 60 |
反应①CH3OH(g)⇌CO(g)+2H2(g)的平衡常数表达式K=
| c(CO)c 2(H 2) |
| c(CH 3OH) |
故答案为:0.001mol/(L•s);
| c(CO)c 2(H 2) |
| c(CH 3OH) |
②因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动,则恒压转化率大于恒容,故a2大于a1;故答案为:大于;因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动;
(3)因为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H=-162kJ•mol-1,则该反应为气体体积减小的放热反应,所以升温向逆反应方向进行,加压则向正反应方向进行,而实验测得在T1和Pl与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,所以Pl>P2;故答案为:>;
(4)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;故答案为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;故答案为:硫酸;
(5)标准状况下,22.4L的甲烷完全燃烧生成的CO2的物质的量为:
| 22.4 |
| 22.4 |
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
看了 甲醇、天燃气是重要的化工原料...的网友还看了以下:
初三化学进煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染.有一种煤每燃烧1t就会释放出5 2020-03-31 …
工业上以土矿为原料生成铝,主要包括下1将粉碎,筛选后的铝土矿溶解在氢氧化钠溶液中2通入过量二氧化碳 2020-04-26 …
生活中常用CaC2固体和水反应制取乙炔气体(化学式:C2H2),同时还生成一种碱.则生成乙炔的化学 2020-05-14 …
煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染.科学上用熟石灰来完全吸收SO2,其反应 2020-05-16 …
煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染,科学上用熟石灰来完全吸收SO2.其反应 2020-05-16 …
煤是一种化石燃料,用煤作燃料生成的SO2气体会污染环境.煤是一种化石燃料,用煤作燃料生成的SO2气 2020-05-16 …
龙葵醛()是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一 2020-06-27 …
亚硝酸钠(NaNO2)是重要的防腐剂.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制 2020-07-08 …
(2013•大兴区二模)四氯化钛(TiCl4)可用作陶瓷工业着色剂,涂料工业用于制造油漆催干剂等. 2020-07-13 …
菠萝酯常用作化妆品香料,其合成方法如下:下列说法不正确的是()A.原料生成中间产物的反应属于取代反应 2020-10-29 …