早教吧作业答案频道 -->化学-->
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.(1)工业上二氧化钛的制备方法是:Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化
题目详情
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是___;分离二者所采取的操作名称是___.
②Ⅲ中反应的化学方程式是___.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在___(填字母序号图 1)中加热.
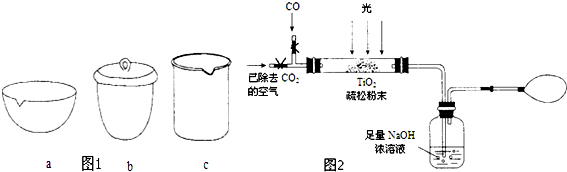
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的___(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为___.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是___.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
②Ⅲ中反应的化学方程式是___.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在___(填字母序号图 1)中加热.

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的___(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为___.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是___.
▼优质解答
答案和解析
工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.四氯化钛和四氯化硅熔沸点差别较小,可以采用蒸馏方法将SiCl4分离,得到纯净的TiCl4;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2•xH2O,同时生成HCl;
Ⅳ.将TiO2•xH2O高温分解得到TiO2和水;
①熔沸点差别较小的物质采用蒸馏方法分离,根据表中数据知,二者在常温下都是液态,且二者熔沸点差别较小,可以采用蒸馏方法分离,故答案为:液态;蒸馏;
②由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为TiCl4+(x+2)H2O
TiO2•xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O
TiO2•xH2O↓+4HCl;
③Ⅳ为高温分解固体物质,通常在坩埚中进行,故选b;
(2)①CxHy、CO等具有还原性,H2O2具有强氧化性,所以双氧水体现氧化性,故答案为:氧化性;
②双氧水具有强氧化性,能够将一氧化碳氧化成二氧化碳,据此写出反应的化学方程式;
(3)①NaOH溶液增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:
=0.25mol,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:n(CO)=n(CO2)=0.25mol,气体中n(CO)=
=1mol,CO的转化率=
×100%=25%,
故答案为:25%;
②装置中有残留的CO2气体,通一会空气,将残留在装置中的CO2气体排出,以便被NaOH溶液吸收,从而减小误差,
故答案为:将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.四氯化钛和四氯化硅熔沸点差别较小,可以采用蒸馏方法将SiCl4分离,得到纯净的TiCl4;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2•xH2O,同时生成HCl;
Ⅳ.将TiO2•xH2O高温分解得到TiO2和水;
①熔沸点差别较小的物质采用蒸馏方法分离,根据表中数据知,二者在常温下都是液态,且二者熔沸点差别较小,可以采用蒸馏方法分离,故答案为:液态;蒸馏;
②由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为TiCl4+(x+2)H2O
| ||
| ||
③Ⅳ为高温分解固体物质,通常在坩埚中进行,故选b;
(2)①CxHy、CO等具有还原性,H2O2具有强氧化性,所以双氧水体现氧化性,故答案为:氧化性;
②双氧水具有强氧化性,能够将一氧化碳氧化成二氧化碳,据此写出反应的化学方程式;
(3)①NaOH溶液增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:
| 11g |
| 44g/mol |
| 22.4L |
| 22.4L/mol |
| 0.25mol |
| 1mol |
故答案为:25%;
②装置中有残留的CO2气体,通一会空气,将残留在装置中的CO2气体排出,以便被NaOH溶液吸收,从而减小误差,
故答案为:将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
看了 纳米材料二氧化钛(TiO2)...的网友还看了以下:
下列不属于二氧化碳的化学性质的是为什么?下列不属于二氧化碳的化学性质的是A二氧化碳能与水反应B二氧 2020-04-26 …
1.有二氧化碳与一氧化碳的混合气体共10.8g,其物质的量为0.3mol,求混合气体中二氧化碳与一 2020-05-12 …
化学物质的量物质组成氧化亚铁三氧化二铁四氧化三铁三种氧化物中,与等量铁原子上结合的氧原子的质量比为 2020-05-13 …
物质的性质决定其用途.下列物质的用途与性质对应关系错误的是()A.固体二氧化碳可用人工降雨---- 2020-05-13 …
物质的性质决定了物质的用途,下列性质与用途说法错误的是()A.二氧化碳不支持燃烧,通常可用于灭火B 2020-05-13 …
【在CO2与CO的混合气体中,碳元素与氧元素的质量之比为1:2,则二氧化碳与一氧化碳的质量之比为_ 2020-05-16 …
如何判断过氧化钠与物质反应是否有氧气生成在什么时候过氧化钠与物质反应时,首先生成氧气,再由氧气氧化 2020-05-17 …
物质燃烧一定要氧气参与吗?书上给的定义是,燃烧是可燃物与“氧气”发生一种发光、放热的剧烈的氧化反应 2020-05-17 …
完全变质或部分变质的氢氧化钠与没变质的氢氧化钠相比,中和反应时消耗强酸的量是()完全变质或部分变质 2020-05-21 …
有关氧气化学性质的叙述正确的是()A.化学性质很活泼,能与所有的物质发生反应B.氧气有可燃性,是一 2020-05-24 …