已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是()A.a点溶液
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )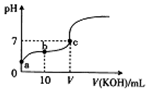
A. a点溶液中c(H+)为4.0×10-5mol/L
B. c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-)
C. V=20
D. a、b、c三点中水的电离程度最大的是c点
| x×x |
| 0.01 |
B.c点溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(K+)=c(CH3COO-),正确的离子浓度大小顺序为:c(K+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;
C.V点溶液的pH=7,溶液呈中性,当V=20时恰好反应生成醋酸钠,溶液呈碱性,当为中性时,加入的NaOH溶液体积稍小,即V<20,故C错误;
D.根据图象可知,a、c溶液呈酸性,氢离子抑制了水的电离,水电离的c(H+)<1×10-7mol/L,而c点溶液的pH=7,呈中性,水电离的氢离子浓度为1×10-7mol/L,所以a、b、c三点中水的电离程度最大的是c点,故D正确;
故选D.
解下列方程(3-x)/2=(x-4)/35x/24=(3x-4)/8-2(y-z)/2=2-(3y 2020-04-07 …
(2014•河北一模)如图所示,在边长为l的正三角形ABC的三个顶点上分别放有三个点电荷:-2q、 2020-04-11 …
边缘粗糙,半径不同的两个轮子,作无滑动的摩擦传动.AB是大轮O上的两点,OA=R=0.8m,OB= 2020-05-13 …
进行下列数的数制转换(213)D=()B=()H=()O(69.625)D=()B=()H=()O 2020-05-21 …
下列IP地址中,正确的IP主机地址是( ) A.202.1.10.OB.100.O.O.0C.129 2020-05-23 …
下列IPv6地址表示中,错误的是( )。A.::10F:BC:0:O:03DAB.FE00::0:4 2020-05-23 …
下列IPv6地址表示中,错误的是( )。A.::l2D:BC:O:05E6B.DA21:0:0:0: 2020-05-23 …
下列对IPv6地址FE01:O:O:050D:23:O:O:03D4的简化表示中,错误的是( )。A 2020-05-23 …
下列对IPv6地址FA32:0:0:0801:FE:0:O:Al50的简化表示中,错误的是( )。A 2020-05-23 …
从二叉搜索树中查找一个元素时,其时间复杂度大致为()。A.0(n)B.O(1)C.0(log2n)D 2020-05-24 …