早教吧作业答案频道 -->化学-->
化学反应原理是中学化学学习的重要内容.请回答下列问题:(1)下列判断正确的是.①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2则△H1<△H2②H2(g
题目详情
化学反应原理是中学化学学习的重要内容.请回答下列问题:
(1)下列判断正确的是___.
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
则△H1<△H2
②H2(g)+
O2(g)═H2O(l)△H1
2H2(g)+O2(g)═2H2O(l)△H2
则△H1<△H2
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1<Q2
④CaCO3(s)═CaO(s)+CO2(g)△H1
CaO(s)+H2O(l)═Ca(OH)2(s)△H2
则△H1<△H2
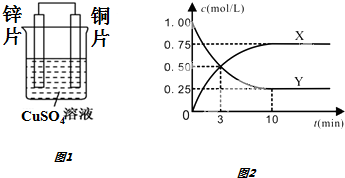
(2)依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图1所示.
请回答下列问题:
①铜电极发生的电极反应为___.
②溶液中Cu2+向___极移动.
(3)在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH (g)+H2O(g)△H=-49.0kJ/mol某种反应物和生成物的浓度随时间变化如图2所示.
回答下列问题:
①Y的化学式是___.
②反应进行到3min时,v正___v逆(填“>”或“<”、“=”).反应前3min,H2的平均反应速率v(H2)=___mol•L-1•min-1.
③能证明该反应达到化学平衡状态的依据是___.
A.容器内各气体的体积分数保持不变
B.混合气体密度不变
C.3v逆(CH3OH)=v正(H2)
D.混合气体的平均相对分子质量不变
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g)+H2O(g)⇌CO2(g)+3H2(g)的平衡常数K=___(计算结果保留2位小数).
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将___(填“向左”、“向右”或“不”)移动.
(4)室温时,向20mL 0.1mol/L的醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如图所示.下列有关溶液中离子、分子浓度大小关系的描述中正确的是___.
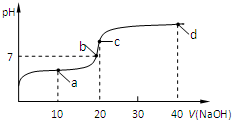
①.a点时:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②.b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)

(1)下列判断正确的是___.
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
则△H1<△H2
②H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)═2H2O(l)△H2
则△H1<△H2
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1<Q2
④CaCO3(s)═CaO(s)+CO2(g)△H1
CaO(s)+H2O(l)═Ca(OH)2(s)△H2
则△H1<△H2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图1所示.
请回答下列问题:
①铜电极发生的电极反应为___.
②溶液中Cu2+向___极移动.
(3)在一恒温、恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH (g)+H2O(g)△H=-49.0kJ/mol某种反应物和生成物的浓度随时间变化如图2所示.
回答下列问题:
①Y的化学式是___.
②反应进行到3min时,v正___v逆(填“>”或“<”、“=”).反应前3min,H2的平均反应速率v(H2)=___mol•L-1•min-1.
③能证明该反应达到化学平衡状态的依据是___.
A.容器内各气体的体积分数保持不变
B.混合气体密度不变
C.3v逆(CH3OH)=v正(H2)
D.混合气体的平均相对分子质量不变
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g)+H2O(g)⇌CO2(g)+3H2(g)的平衡常数K=___(计算结果保留2位小数).
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将___(填“向左”、“向右”或“不”)移动.
(4)室温时,向20mL 0.1mol/L的醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如图所示.下列有关溶液中离子、分子浓度大小关系的描述中正确的是___.

①.a点时:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②.b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
▼优质解答
答案和解析
(1)①气态水变化为液态水过程放热,甲烷燃烧生成液体水放热大于甲烷反应生成气体水,焓变包含负号比较,△H1<△H2
②氢气和氧气反应相同条件下量不同反应热不同,1mol氢气燃烧生成液态水放出热量小于2mol氢气燃烧生成液态水放出热量,焓变包含负号比较,△H1>△H2
③二氧化硫和氧气反应生成三氧化硫的反应是气体体积减小的放热反应,恒容容器中反应进行过程中压强减小,恒压容器中反应过程中压强比恒容容器中的反应物转化率大,Q12,
④碳酸钙分解吸热,氧化钙和水反应放热,焓变包含负号比较,△H1>△H2
综上所述:①③符合;
故答案为:①③;
(2)氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池,铜做正极,锌做负极,溶液中铜离子移向正极,
①铜电极做原电池正极,发生的电极反应为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
②原电池反应过程中电解质溶液中阳离子移向正极,阴离子移向负极,故答案为:正;
(3)①由图可知反应进行到3min时,消耗的Y和生成的X均为0.5mol,说明二者的计量数相同,已知CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
则反应物Y为CO2,故答案为:CO2;
②反应进行到3min时,反应未到达平衡状态,反应仍正向进行,所以v正>v逆;反应前3min,消耗的二氧化碳为1.00-0.50=0.50mol/L,则消耗的氢气为
0.50mol/L×3=1.50mol/L,则v(H2)=
=0.5mol•L-1•min-1,
故答案为:>;0.5;
③在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,
A.容器内各气体的体积比保持不变,说明各物质的量保持不变,所以证明已经达到平衡状态,故A正确;
B.混合气体的体积不变,质量守恒,所以混合气体的密度始终不变,所以不能证明已经达到平衡状态,故B错误;
C.达到平衡状态时,不同物质的反应速率之比等于计量数之比,即是平衡状态,所以3v逆(CH3OH)=v正(H2) 时,说明已经达到平衡状态,故C正确;
D.由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,所以氢气的转化率为
×100%=75%,故D正确;
故答案为:ACD;
④反应CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)是反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的逆反应,二者的平衡常数互为倒数的关系,则K′=
=
=0.9,故答案为:0.19;
⑤由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,生成的c(CH3OH)=c(H2O)=0.75mol/L;
则平衡时c(CO2)=0.25mol/L,c(H2)=0.75mol/L,c(CH3OH)=0.75mol/L,c(H2O)=0.75mol/L,
则K=
=
=5.33,往容器中同时加入1molCO2和1mol H2O(g),则Qc=
=2.49<K=5.33,则反应未到达平衡状态,所以反应向右进行,
故答案为:向右;
(4)①.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,应存在c(CH3COO-)>c(CH3COOH),故①错误;
②.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,应有c(H+)=c(OH-),则c(Na+)=c(CH3COO-),故②正确;
③.c点时,溶液呈碱性,应有c(H+)<c(OH-),溶液中存在质子守恒,c(OH-)=c(CH3COOH)+c(H+),故③正确;
④.d点为NaOH和CH3COONa的混合物,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故④错误.
故选②③.
②氢气和氧气反应相同条件下量不同反应热不同,1mol氢气燃烧生成液态水放出热量小于2mol氢气燃烧生成液态水放出热量,焓变包含负号比较,△H1>△H2
③二氧化硫和氧气反应生成三氧化硫的反应是气体体积减小的放热反应,恒容容器中反应进行过程中压强减小,恒压容器中反应过程中压强比恒容容器中的反应物转化率大,Q1
④碳酸钙分解吸热,氧化钙和水反应放热,焓变包含负号比较,△H1>△H2
综上所述:①③符合;
故答案为:①③;
(2)氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池,铜做正极,锌做负极,溶液中铜离子移向正极,
①铜电极做原电池正极,发生的电极反应为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
②原电池反应过程中电解质溶液中阳离子移向正极,阴离子移向负极,故答案为:正;
(3)①由图可知反应进行到3min时,消耗的Y和生成的X均为0.5mol,说明二者的计量数相同,已知CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
则反应物Y为CO2,故答案为:CO2;
②反应进行到3min时,反应未到达平衡状态,反应仍正向进行,所以v正>v逆;反应前3min,消耗的二氧化碳为1.00-0.50=0.50mol/L,则消耗的氢气为
0.50mol/L×3=1.50mol/L,则v(H2)=
| 1.50mol |
| 3min |
故答案为:>;0.5;
③在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,
A.容器内各气体的体积比保持不变,说明各物质的量保持不变,所以证明已经达到平衡状态,故A正确;
B.混合气体的体积不变,质量守恒,所以混合气体的密度始终不变,所以不能证明已经达到平衡状态,故B错误;
C.达到平衡状态时,不同物质的反应速率之比等于计量数之比,即是平衡状态,所以3v逆(CH3OH)=v正(H2) 时,说明已经达到平衡状态,故C正确;
D.由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,所以氢气的转化率为
| 2.25 |
| 3 |
故答案为:ACD;
④反应CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)是反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的逆反应,二者的平衡常数互为倒数的关系,则K′=
| 1 |
| K |
| 1 |
| 5.33 |
⑤由图可知,达到平衡状态时二氧化碳转化了0.75mol/L,则H2转化了0.75mol/L×3=2.25mol/L,生成的c(CH3OH)=c(H2O)=0.75mol/L;
则平衡时c(CO2)=0.25mol/L,c(H2)=0.75mol/L,c(CH3OH)=0.75mol/L,c(H2O)=0.75mol/L,
则K=
| c(CH3COOH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
| 0.75×(1+0.75) |
| (0.25+1)×0.753 |
故答案为:向右;
(4)①.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,应存在c(CH3COO-)>c(CH3COOH),故①错误;
②.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,应有c(H+)=c(OH-),则c(Na+)=c(CH3COO-),故②正确;
③.c点时,溶液呈碱性,应有c(H+)<c(OH-),溶液中存在质子守恒,c(OH-)=c(CH3COOH)+c(H+),故③正确;
④.d点为NaOH和CH3COONa的混合物,溶液呈碱性,由于CH3COO-存在微弱的水解,则有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故④错误.
故选②③.
看了 化学反应原理是中学化学学习的...的网友还看了以下:
反应热的计算格式就是给几个热化学方程式,后面给他的反应热,然后让你求目标热化学方程式的反应热这种题的 2020-03-30 …
EXCLE表格中A列,B列,C列均有下拉菜单选项,对应D列,如何做到,D列随着A,B,C改变而改变? 2020-03-30 …
EXCEL中A、B、C、D列,如A列大于100,则B列数值不变,如A列小于100,则B列数值除以2 2020-04-07 …
可以在C列输入公式=IF(A2>B2,A2,"")意思是如果A列大于B列在C列显示A列的值,否则显 2020-04-08 …
求两条Excel函数公式第一条:A、B、C列中的数字0、2、4、6、8划分为偶数,1、3、5、7、 2020-04-09 …
将奇数1,3,5如图排列各列分别用A、B、C、D、E表示,则2013所在的行列为()A.251行D 2020-05-13 …
数列{an}的前项n的和为Sn,存在常数A、B、C,使得an+Sn=An^2+Bn+C对任意正整数 2020-05-16 …
用Excel函数整理数据,合并同类项并实现数量累加?A列 B列 C列 D列 E列数量 规格 2020-05-16 …
12克石墨在24克氧气中燃烧至反应物完全被消耗,测的放出热量x千焦,已知在该条件下,1mol石墨完 2020-05-23 …
excel表格中,E列为60,A列为10,B列为50,C列20,D列为40,如何设值E列既等于A列 2020-06-12 …