早教吧作业答案频道 -->化学-->
铝是目前人们在生产、生活中使用较多的一种金属.(1)铝原子的电子排布如图所示,下列说法正确的是(填序号).A.铝的相对原子质量为13B.铝元素是地壳中含量最多的元素C.铝原
题目详情
铝是目前人们在生产、生活中使用较多的一种金属.
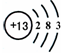
(1)铝原子的电子排布如图所示,下列说法正确的是___(填序号).
A.铝的相对原子质量为13
B.铝元素是地壳中含量最多的元素
C.铝原子在反应中容易得到电子
D.铝元素在化合物中的化合价为+3价
(2)在做活泼金属与酸反应的实验中,小明误将氢氧化钠溶液当成酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,化学实验小组进行了以下探究活动.
【提出猜想】小明猜想是氧气;小红猜想是氢气;小亮猜想是二氧化碳.
其他同学认为小亮的猜想是错误的,理由是___.
【进行实验】利用图1和图2所示的装置分别进行实验.
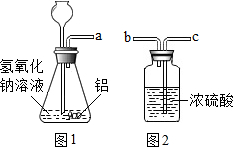
①小明:反应一段时间后,将带火星的木条放在a处,观察到___,则他的猜想错误.
②小红:用图2所示装置干燥从a导管出来的气体,将管口a与___(填“b”或“c”)端管口连接,反应一段时间,点燃干燥的气体,通过对现象的分析,得出她的猜想争取.
【得出结论】铝、氢氧化钠和水反应生成氢气和偏铝酸钠(NaAlO2),反应的化学方程式为___.
【交流讨论】有同学认为,小红的实验方案有欠缺,步骤中存在安全隐患,理由是___.
【反思提升】许多重大科学发展,源自对实验中异常现象的大胆质疑,伸入研究.下列科学成果中___是通过对异常现象研究得出的.
A.波义耳不慎将浓盐酸溅到花瓣上从而发现了酸碱指示剂
B.侯德榜潜心研究制碱技术发明了联合制碱法
C.拉瓦锡伸入研究前人忽视的异常现象发现了氧气
D.张青莲主持测定了多种元素的相对原子质量的新值
(3)若用足量的铝与40g氢氧化钠溶液反应制取1.2g氢气,则所需氢氧化钠溶液的质量分数是多少?

(1)铝原子的电子排布如图所示,下列说法正确的是___(填序号).
A.铝的相对原子质量为13
B.铝元素是地壳中含量最多的元素
C.铝原子在反应中容易得到电子
D.铝元素在化合物中的化合价为+3价
(2)在做活泼金属与酸反应的实验中,小明误将氢氧化钠溶液当成酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,化学实验小组进行了以下探究活动.
【提出猜想】小明猜想是氧气;小红猜想是氢气;小亮猜想是二氧化碳.
其他同学认为小亮的猜想是错误的,理由是___.
【进行实验】利用图1和图2所示的装置分别进行实验.

①小明:反应一段时间后,将带火星的木条放在a处,观察到___,则他的猜想错误.
②小红:用图2所示装置干燥从a导管出来的气体,将管口a与___(填“b”或“c”)端管口连接,反应一段时间,点燃干燥的气体,通过对现象的分析,得出她的猜想争取.
【得出结论】铝、氢氧化钠和水反应生成氢气和偏铝酸钠(NaAlO2),反应的化学方程式为___.
【交流讨论】有同学认为,小红的实验方案有欠缺,步骤中存在安全隐患,理由是___.
【反思提升】许多重大科学发展,源自对实验中异常现象的大胆质疑,伸入研究.下列科学成果中___是通过对异常现象研究得出的.
A.波义耳不慎将浓盐酸溅到花瓣上从而发现了酸碱指示剂
B.侯德榜潜心研究制碱技术发明了联合制碱法
C.拉瓦锡伸入研究前人忽视的异常现象发现了氧气
D.张青莲主持测定了多种元素的相对原子质量的新值
(3)若用足量的铝与40g氢氧化钠溶液反应制取1.2g氢气,则所需氢氧化钠溶液的质量分数是多少?
▼优质解答
答案和解析
(1)
A、据铝原子的结构示意图可知:铝原子的相质子数为13,无法确定相对原子质量,故错误;
B、氧元素是地壳中含量最多的元素,铝位于第二,故错误;
C、由该元素的原子结构示意图可知,最外层电子数是3,小于4,该元素的原子容易失去电子,故正确;
D、由该元素的原子结构示意图可知,最外层电子数是3,小于4,该元素的原子容易失去电子,形成阳离子,铝元素在化合物中的化合价为+3价,故正确.
(2):【提出猜想】根据质量守恒定律,化学反应前后元素的种类不变,反应前无碳元素,反应后也无碳元素,故小雨猜想是错误的;
【进行实验】①氧气能够支持燃烧,反应一段时间后,将带火星的木条放在a处,观察到带火星的木条不复燃,则她的猜想是错误的.
②浓硫酸干燥气体是从长管进,用图Ⅱ所示装置干燥从a导管出来的气体,将管口a与c端管口连接;
【得出结论】铝、氢氧化钠和水反应生成氢气和偏铝酸钠(NaAlO2),反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
【交流讨论】氢气具有可燃性,点燃时易发生爆炸;
【反思提升】根据研究成果可知:有两项是通过对异常现象研究得出的.它们是波义耳不慎将浓盐酸见到花瓣上从而发现了酸碱指示剂,拉瓦锡深入研究前人忽视的异常现象发现了氧气;
(3)所需氢氧化钠的质量为x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
80 6
x 1.2g
=
x=16g
则所需氢氧化钠溶液的质量分数是:
×100%=40%.
故答案为:
(1)D;
(2)【提出猜想】化学反应前后元素的种类不变,反应前无碳元素,反应后也无碳元素;
【进行实验】①带火星的木条不复燃;②c;
【得出结论】2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
【交流讨论】氢气具有可燃性,点燃时易发生爆炸;
【反思提升】AC.
(3)则所需氢氧化钠溶液的质量分数是40%.
(1)
A、据铝原子的结构示意图可知:铝原子的相质子数为13,无法确定相对原子质量,故错误;
B、氧元素是地壳中含量最多的元素,铝位于第二,故错误;
C、由该元素的原子结构示意图可知,最外层电子数是3,小于4,该元素的原子容易失去电子,故正确;
D、由该元素的原子结构示意图可知,最外层电子数是3,小于4,该元素的原子容易失去电子,形成阳离子,铝元素在化合物中的化合价为+3价,故正确.
(2):【提出猜想】根据质量守恒定律,化学反应前后元素的种类不变,反应前无碳元素,反应后也无碳元素,故小雨猜想是错误的;
【进行实验】①氧气能够支持燃烧,反应一段时间后,将带火星的木条放在a处,观察到带火星的木条不复燃,则她的猜想是错误的.
②浓硫酸干燥气体是从长管进,用图Ⅱ所示装置干燥从a导管出来的气体,将管口a与c端管口连接;
【得出结论】铝、氢氧化钠和水反应生成氢气和偏铝酸钠(NaAlO2),反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
【交流讨论】氢气具有可燃性,点燃时易发生爆炸;
【反思提升】根据研究成果可知:有两项是通过对异常现象研究得出的.它们是波义耳不慎将浓盐酸见到花瓣上从而发现了酸碱指示剂,拉瓦锡深入研究前人忽视的异常现象发现了氧气;
(3)所需氢氧化钠的质量为x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
80 6
x 1.2g
| 80 |
| x |
| 6 |
| 1.2g |
x=16g
则所需氢氧化钠溶液的质量分数是:
| 16g |
| 40g |
故答案为:
(1)D;
(2)【提出猜想】化学反应前后元素的种类不变,反应前无碳元素,反应后也无碳元素;
【进行实验】①带火星的木条不复燃;②c;
【得出结论】2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
【交流讨论】氢气具有可燃性,点燃时易发生爆炸;
【反思提升】AC.
(3)则所需氢氧化钠溶液的质量分数是40%.
看了 铝是目前人们在生产、生活中使...的网友还看了以下:
△÷()=□……6,括号里可以填:,最小填.△÷5=□……()括△÷()=□……6,括号里可以填: 2020-04-07 …
下面的括号里可以填的最大整数是多少?①514×79<5()②23×()8<58③79×()3<35 2020-04-07 …
399()566约400万,()里可填的最小数字是多少? 2020-04-07 …
读“中国地形分布空白图”回答:(1)填出下列代号所表示的主要地形区名称:ABCEGHJK(2)我国 2020-05-13 …
2×20×54×()的积是一个立方数,则括号中可填的最小自然数是什么数? 2020-05-14 …
要使735×36×150×()的积的末四位数都是零,那么()中应填的最小自然数是多少. 2020-05-14 …
词语填空,日()不()()()不已()无()意()无所()怒气()()()情难()各()各()() 2020-05-16 …
填入下列横线处的句子,衔接最恰当的一项是:…………………………………()人总是需要一点精神的,填入 2020-05-17 …
一段填标点的段落就是给一段话,全没标点,让我填的.最好再有一段改错的, 2020-06-05 …
初一上学期习题,1.甲看乙的方向是北偏东30°,则乙看甲的方向是().填的是列入(南偏西30°)乱 2020-06-06 …