向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体.一定条件下发生反应,各物质的浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况
向1L的密闭容器中加入1mol X、0.3mol Z和一定量的Y三种气体.一定条件下发生反应,各物质的浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.下列说法不正确的是( )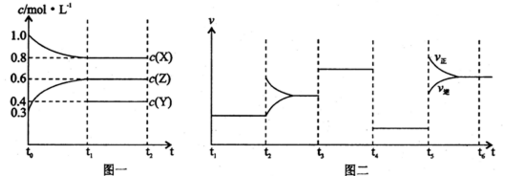
A. Y的起始物质的量为0.5 mol
B. 该反应的化学方程式为:2X(g)+Y(g)⇌3Z(g)△H<0
C. 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s)
D. 反应物X的转化率t6点比t3点高
A.X减少0.2mol/L,则Y减少0.1mol/L,则起始Y的浓度为0.4mol/L+0.1mol/L=0.5mol/L,起始物质的量为0.5mol/L×1L=0.5mol,故A正确;
B.上述计算得到化学方程式为:2X(g)+Y(g)⇌3Z(g),图象分析可知升温平衡正向进行说明正反应为吸热反应,故B错误;
C.若t0=0,t1=10 s,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则t0~t1阶段的平均反应速率为v(Z)=
| 0.3mol/L |
| 10s |
D.分析可知t5~t6为升高温度,平衡正向进行,反应物X的转化率t6点比t3点高,故D正确;
故选B.
《金融资产管理公司条例》第三条规定,金融资产管理公司以最大限度地( )为主要经营目标,依 2020-05-21 …
《金融资产管理公司条例》第三条规定,金融资产管理公司以最大限度地( )为主要经营目标,依法独立 2020-05-21 …
新《保险法》第三十三条规定,投保人不得为无民事行为能力人投保以( )为给付保险金条件的人身保 2020-05-22 …
《统计执法检查规定》第三十三条规定,“统计执法检查机关在作出对()的行政处罚决定前,应当告知当 2020-06-07 …
《十二铜表法》第六表三条规定:''凡占有土地(包括房屋)二年《十二铜表法》第6表第3条规定:“凡占 2020-06-17 …
1、以营利为目的,有下列情形之一的,属于刑法第三百零三条规定的“聚众赌博”:(一)组织31、以营利 2020-06-26 …
究竟什么是违停拜托各位了3Q按照交通法第五十六条规定“机动车应当在规定地点停放.禁止在人行道上停放 2020-07-10 …
合同法:关于格式合同第四十条格式条款具有本法第五十二条和第五十三条规定情形的,或者提供格式条款一方免 2020-11-07 …
预防未成年人犯罪法第三十三条规定:“营业性舞厅及其他未成年人不宜进入的场所,应当设置明显的禁止标志, 2020-12-02 …
某市用水收费标准是:水费=基本费+超额费+定额损耗费,且以下有三条规定1,若每月用水量最低限量m立方 2021-01-09 …