早教吧作业答案频道 -->化学-->
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:方案一滴定法用酸性KMnO4溶液滴定测定铁元素的含量.反应原理:5F
题目详情
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量.
反应原理:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___(填仪器名称).
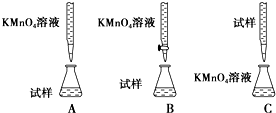
(2)某同学设计的下列滴定方式中,最合理的是___(夹持部分略去)(填字母序号).
方案二 重量法 操作流程如下:
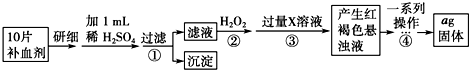
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:___
(4)步骤④中一系列操作依次是:___、___、___、___、称量.
II:六水合硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
图1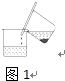
步骤1:铁屑的处理.将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥.
步骤2:FeSO4溶液的制备.向锥形 瓶中加入30mL的3 mol•L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止.趁热过滤(如图2所示),收集滤液和洗涤液.
图2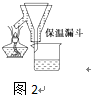
步骤3:六水合硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体.
请回答下列问题:
(1)趁热过滤的目的和理由是___
(2)①步骤3中的一系列操作包括___,___、___.
②洗涤硫酸亚铁铵晶 体最好用什么试剂:___.
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量.
反应原理:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___(填仪器名称).
(2)某同学设计的下列滴定方式中,最合理的是___(夹持部分略去)(填字母序号).

方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:___
(4)步骤④中一系列操作依次是:___、___、___、___、称量.
II:六水合硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
图1

步骤1:铁屑的处理.将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥.
步骤2:FeSO4溶液的制备.向锥形 瓶中加入30mL的3 mol•L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止.趁热过滤(如图2所示),收集滤液和洗涤液.
图2

步骤3:六水合硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体.
请回答下列问题:
(1)趁热过滤的目的和理由是___
(2)①步骤3中的一系列操作包括___,___、___.
②洗涤硫酸亚铁铵晶 体最好用什么试剂:___.
▼优质解答
答案和解析
(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀为氢氧化亚铁,空气中氢氧化亚铁被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)步骤④中一系列操作依次是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;灼烧;冷却;
II:(1)趁热过滤的目的和理由是过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失,
故答案为:过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失;
(2)①向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作蒸发浓缩、冷却结晶、过滤洗涤后得到六水合硫酸亚铁铵晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
②硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水,
故答案为:乙醇.
故答案为:250mL容量瓶;
(2)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀为氢氧化亚铁,空气中氢氧化亚铁被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)步骤④中一系列操作依次是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;灼烧;冷却;
II:(1)趁热过滤的目的和理由是过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失,
故答案为:过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失;
(2)①向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作蒸发浓缩、冷却结晶、过滤洗涤后得到六水合硫酸亚铁铵晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
②硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水,
故答案为:乙醇.
看了 硫酸亚铁晶体(FeSO4•7...的网友还看了以下:
设计原电池时,若给出的化学方程式是zn+h2so4=znso4+h2,此时电解质溶液只能是西硫设计 2020-05-14 …
50mlKI溶液中通入适量的cl2二者恰好完全反应,反应后蒸发溶液,灼烧固体,最后剩余固体7.45 2020-07-03 …
据图乙分析正常人尿中不含葡萄糖的主要原因是()A.[6]的血液中胰岛素含量不正常B.[6]处血液中 2020-07-07 …
观察如图,下列叙述中错误的是()A、图中操作发生了化学变化B、液体X的pH>7,液体Y是一种黑色黏 2020-07-07 …
(1)原电池是将能转化为能的装置.其中,电子流出的一极是原电池的极,该极发生反应.(2)用铜和硫酸 2020-07-29 …
将反应H3AsO4+2H(负离子)+2I(负离子)=H3AsO3+I2+H2O设计成原电池.当PH 2020-07-31 …
谁会这道题:(1)mg铁屑与含有ngH(1)mg铁屑与含有ngHNO3的硝酸溶液恰好完全反应,若m: 2020-11-01 …
水处理设备试剂!絮凝剂和还原剂是固体的?但我们反渗透水处理设备原厂提供的絮凝剂和还原剂却是液体的!我 2020-11-29 …
2005年7月24日,A公司接受B公司捐赠的一台七成新机器设备,根据B公司提供购买这台设备时有关发票 2020-12-05 …
溶液的酸碱性常用来检验;溶液的酸碱度常用pH来表示.(1)pH的范围①pH=7溶液呈性②pH<7溶液 2021-01-12 …