早教吧作业答案频道 -->化学-->
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是反应①:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1CO(g
题目详情
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
CO(g)+
O2(g)=CO2(g)△H2=-283kJ•mol-1
H2(g)+
O2(g)=H2O(g)△H3=-242kJ•mol-1
则反应①的△H=___(用△H1、△H2和△H3表示).
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图1所示.
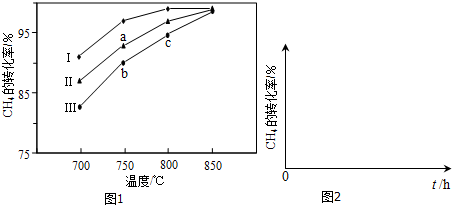
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是___.
②a点所代表的状态___(填“是”或“不是”)平衡状态.
③c点CH4的转化率高于b点,原因是___.
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1:2,10h后CH4的转化率为80%,并测得c(H2O)=0.132mol•L-1,计算0~10h内消耗CH4的平均反应速率(写出计算过程,结果保留2位有效数字).
(4)在如图2的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注).
反应①:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则反应①的△H=___(用△H1、△H2和△H3表示).
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图1所示.

①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是___.
②a点所代表的状态___(填“是”或“不是”)平衡状态.
③c点CH4的转化率高于b点,原因是___.
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1:2,10h后CH4的转化率为80%,并测得c(H2O)=0.132mol•L-1,计算0~10h内消耗CH4的平均反应速率(写出计算过程,结果保留2位有效数字).
(4)在如图2的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注).
▼优质解答
答案和解析
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802kJ•mol-1
②CO(g)+
O2(g)=CO2(g)△H2=-283kJ•mol-1
③H2(g)+
O2(g)=H2O(g)△H3=-242kJ•mol-1
利用盖斯定律将①-②-3×③可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=△H1-△H2-3×△H3,
故答案为:△H1-△H2-3×△H3;
(2)①根据图象,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率为Ⅰ>Ⅱ>Ⅲ,所以三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ,故答案为:Ⅰ>Ⅱ>Ⅲ;
②因为催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同,故a点所代表的状态不是平衡状态,
故答案为:不是;
③此时反应一直向正反应方向移动,b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高,所以c点CH4的转化率高于b点,
故答案为:b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高;
(3)依据化学平衡的三段式列式计算,设CH4与H2O(g)物质的量为a,2a;
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量(mol•L-1) a 2a 0 0
变化量(mol•L-1) 2a-0.132 2a-0.132 2a-0.132 6a-0.396
平衡量(mol•L-1) 0.132-a 0.132 2a-0.132 6a-0.396
10h后CH4的转化率为80%,则
=80%,解得a=0.11,所以0~10h内消耗CH4的平均反应速率V=
=
=8.8×10-3mol/(L•h),
答:0~10h内消耗CH4的平均反应速率为8.8×10-3mol/(L•h);
(4)700℃时化学反应速率比850℃的小,曲线斜率则700℃小,达到平衡需要的时间长,由于该反应为吸热反应,温度降低,CH4的转化率也减小,所以达到平衡时700℃时CH4的转化率比850℃的小,据此画出700℃时CO2的转化率随时间变化的示意图为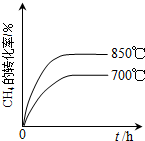 ,
,
故答案为: .
.
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
利用盖斯定律将①-②-3×③可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=△H1-△H2-3×△H3,
故答案为:△H1-△H2-3×△H3;
(2)①根据图象,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率为Ⅰ>Ⅱ>Ⅲ,所以三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ,故答案为:Ⅰ>Ⅱ>Ⅲ;
②因为催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同,故a点所代表的状态不是平衡状态,
故答案为:不是;
③此时反应一直向正反应方向移动,b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高,所以c点CH4的转化率高于b点,
故答案为:b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高;
(3)依据化学平衡的三段式列式计算,设CH4与H2O(g)物质的量为a,2a;
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量(mol•L-1) a 2a 0 0
变化量(mol•L-1) 2a-0.132 2a-0.132 2a-0.132 6a-0.396
平衡量(mol•L-1) 0.132-a 0.132 2a-0.132 6a-0.396
10h后CH4的转化率为80%,则
| 2a-0.132 |
| a |
| △c |
| △t |
| (2×0.11-0.132)mol/L |
| 10h |
答:0~10h内消耗CH4的平均反应速率为8.8×10-3mol/(L•h);
(4)700℃时化学反应速率比850℃的小,曲线斜率则700℃小,达到平衡需要的时间长,由于该反应为吸热反应,温度降低,CH4的转化率也减小,所以达到平衡时700℃时CH4的转化率比850℃的小,据此画出700℃时CO2的转化率随时间变化的示意图为
 ,
,故答案为:
 .
.
看了 甲烷水蒸气重整制合成气是利用...的网友还看了以下:
研发支出如果形成无形资产的按照无形资产成本的150%摊销是什么意思?是加计扣除吗?未形成无形资产的 2020-05-13 …
若资金成本为10%,则M公司购置W型设备这一投资项目的净现值为()万元。A.414.935B.401 2020-05-19 …
若根据比较资金成本法确定该公司最佳的筹资方案,则采用方案甲和方案乙后M公司的综合资金成本分别 2020-05-19 …
根据综合资金成本法选择筹资方案后,若M公司要求A产品投产后的第2年其实现的税前利润总额比第1年 2020-05-19 …
某中学科学研究小组为了探究一种未知物质M的组成,进行有关探究:在密闭容器中装入物质M、氧气、二氧化 2020-06-06 …
结晶玫瑰和高分子树脂M的合成路线如图所示:已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的 2020-07-03 …
请详解以下财务公式加权平均资本成本=(有息负债/投资资本)×债务资本成本×(1-企业所得税税率)+ 2020-07-08 …
某企业共有资本1000万元,其中银行借款100万元,资本成本为6.73%,债券300万元,资本成本 2020-07-17 …
由牛顿第二定律可知,物体质量m=F/a,对于m,F,a三者的关系,下列说法正确的是Aa一定时,m跟F 2020-11-03 …
将次磷酸H3PO2加入硫酸铜溶液中,加热到40℃~50℃,析出一种难溶化合物M,还生成磷酸和硫酸。M 2021-02-01 …