早教吧作业答案频道 -->化学-->
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:反应过程化学方程式焓变△H(kJ/mol)活化能Ea(k
题目详情
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=___kJ•mol-1.
(2)在初始阶段,甲烷蒸气重整的反应速率___甲烷氧化的反应速率(填“大于”、“小于”或“等于”).
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的Kp=___; 随着温度的升高,该平衡常数___(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
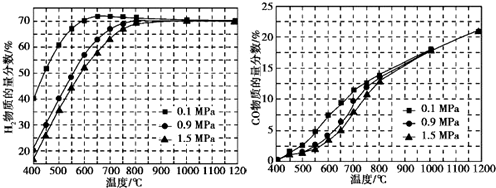
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是___.
A.600℃,0.9MPa B.700℃,0.9Mpa
C.800℃,1.5MPa D.1 000℃,1.5MPa
②画出600℃,0.1MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是___.
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=___kJ•mol-1.
(2)在初始阶段,甲烷蒸气重整的反应速率___甲烷氧化的反应速率(填“大于”、“小于”或“等于”).
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的Kp=___; 随着温度的升高,该平衡常数___(填“增大”、“减小”或“不变”).
(4)从能量角度分析,甲烷自热重整方法的先进之处在于___.
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是___.
A.600℃,0.9MPa B.700℃,0.9Mpa
C.800℃,1.5MPa D.1 000℃,1.5MPa
②画出600℃,0.1MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是___.
▼优质解答
答案和解析
(1)已知:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
根据盖斯定律,①-②可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),故△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol,
故答案为:-41.2;
(2)由表中数据可知,甲烷氧化的活化能低于蒸气重整的活化能,活化能越低,反应速率越快,故初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,故答案为:小于;
(3)可知反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的KP=
;
该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,
故答案为:
;增大;
(4)从能量的角度分析,甲烷自热重整方法的先进之处在于:放热的甲烷氧化反应为吸热的蒸气重整提供能量,提高能源的利用率,
故答案为:放热的甲烷氧化反应为吸热的蒸气重整提供能量;
(5)①由图中数据可知,0.9 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则700℃符合,1.5 MPa时,H2的物质的量分数>65%,则温度要高于750℃,CO物质的量分数<10%,低于750℃,矛盾,故B正确,ACD错误,
故选:B;
②起始进料时H2的物质的量分数为0,结合图象可知600℃,0.1 MPa的条件下,平衡时系统中H2的物质的量分数达到70%,H2的物质的量分数随时间变化的示意图为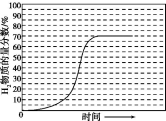 ,故答案为:
,故答案为: ;
;
(6)如果反应过程中进氧气的量过大,会导致生成的氢气和氧气反应,导致质量分数降低,故答案为:导致生成的氢气和氧气反应.
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
根据盖斯定律,①-②可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),故△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol,
故答案为:-41.2;
(2)由表中数据可知,甲烷氧化的活化能低于蒸气重整的活化能,活化能越低,反应速率越快,故初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,故答案为:小于;
(3)可知反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)的KP=
| p3(H2)×p(CO) |
| p(CH4)×p(H2O) |
该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,
故答案为:
| p3(H2)×p(CO) |
| p(CH4)×p(H2O) |
(4)从能量的角度分析,甲烷自热重整方法的先进之处在于:放热的甲烷氧化反应为吸热的蒸气重整提供能量,提高能源的利用率,
故答案为:放热的甲烷氧化反应为吸热的蒸气重整提供能量;
(5)①由图中数据可知,0.9 MPa时,H2的物质的量分数>65%,CO物质的量分数<10%,则700℃符合,1.5 MPa时,H2的物质的量分数>65%,则温度要高于750℃,CO物质的量分数<10%,低于750℃,矛盾,故B正确,ACD错误,
故选:B;
②起始进料时H2的物质的量分数为0,结合图象可知600℃,0.1 MPa的条件下,平衡时系统中H2的物质的量分数达到70%,H2的物质的量分数随时间变化的示意图为
 ,故答案为:
,故答案为: ;
;(6)如果反应过程中进氧气的量过大,会导致生成的氢气和氧气反应,导致质量分数降低,故答案为:导致生成的氢气和氧气反应.
看了 甲烷自热重整是先进的制氢方法...的网友还看了以下:
12.质量相等,由不同的物质组成的甲、乙两个物体,降低相等的温度,甲放出的热量比乙放出的热量多,则 2020-05-13 …
读下图,回答下列各题。小题1:图中表示热带雨林气候类型的是()A.甲B.乙C.丙D.丁小题2:图中 2020-05-13 …
甲、乙两地冬季都吹西北风,其成因是()A、甲-海陆热力性质差异;乙-气压带风带移动B、甲-地形;乙 2020-05-13 …
化学甲乙两种气体混合后通入澄清石灰水,石灰水无变化,将灼热至发红的黑色固体丁放到混合气体中,丁燃烧 2020-05-17 …
甲、乙两种气体混合后通入澄清石灰水中,石灰水无明显变化;将灼热至发红光的黑色固体丁放到混合气体中, 2020-05-17 …
若此图代表“三圈环流”中的中纬环流图,则()A.甲是副热带高气压B.乙处多锋面雨C.甲处为极锋D. 2020-06-18 …
什么是增量气,什么是存量气天然气存量气价格上调,给原本火热的甲醇涨势又添了“一把柴”。国家发改委2 2020-07-04 …
如何把下列化学物品合成?氯乙醇二异丙胺硫化氢氢氧化钠甲基氧二氯化磷(三氯化磷与甲醇反应,得亚磷酸二 2020-07-29 …
下列实验能获得成功的是.①甲烷气体通入空气中点燃获得热量②甲烷气体通入氯水中制取一氯甲烷③甲烷通入酸 2020-11-01 …
草酸,丁二酸,乙酰乙酸,甲基丙二酸,尿素哪个受热不产生气体受热放出气体的化合物有什么特点? 2020-11-30 …