早教吧作业答案频道 -->化学-->
氨气在工业上有广泛用途.请回答以下问题:(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/LH2参加合成氨反应,在a、b两种条
题目详情
氨气在工业上有广泛用途.请回答以下问题:
(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A.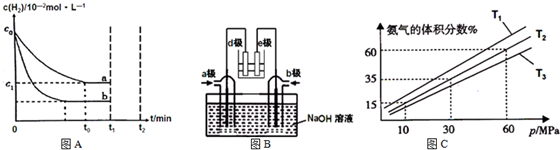
①相对a而言,b可能改变的条件是___,判断的理由是___.
②a条件下,0~t0的平均反应速率v(N2)=___mol•L-1•min-1.
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝.
a极通入___气体(填化学式),判断的理由是___
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为___.
③此时N2的平衡分压为___MPa.(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=___.(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
(1)工业上利用N2(g)+3H2(g)⇌2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A.

①相对a而言,b可能改变的条件是___,判断的理由是___.
②a条件下,0~t0的平均反应速率v(N2)=___mol•L-1•min-1.
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝.
a极通入___气体(填化学式),判断的理由是___
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为___.
③此时N2的平衡分压为___MPa.(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=___.(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
▼优质解答
答案和解析
(1)①a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),
故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=
v(H2)=
×
=
×
=
mol/(L.min),
故答案为:
;
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,
故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;
b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;
c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;
d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;
故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,
故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)⇌2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=
×100%=60%,
x=12,
氮气分压=
×60MPa=9MPa;
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=
=0.043(MPa)-2,
故答案为:9;0.043(MPa)-2.
故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=
| 1 |
| 3 |
| 1 |
| 3 |
| △c |
| △t |
| 1 |
| 3 |
| (c0-c1)mol/L |
| 100t0min |
| c0-c1 |
| 300t0 |
故答案为:
| c0-c1 |
| 300t0 |
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,
故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;
b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;
c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;
d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;
故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,
故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)⇌2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=
| x |
| 9-0.5x+23-1.5x+x |
x=12,
氮气分压=
| 9-0.5×12 |
| 9+23-12 |
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=
| (36MPa)2 |
| (9MPa).(15MPa)3 |
故答案为:9;0.043(MPa)-2.
看了 氨气在工业上有广泛用途.请回...的网友还看了以下:
我是小小数学家,请看我的数学小课题研究.(1)课题一:偶数加偶数的和是奇数还是偶数?奇数加奇数的和 2020-04-09 …
小华比小芳小两岁,比小兰大两岁,小明比小芳大四岁,小兰的年龄是小明的一半.他们各有几岁?(二年级上 2020-04-26 …
“我的花季”(我的青春) 作文一篇 ,小标题作文啊!要求:句势通顺,以小标题式作文(三个小标题), 2020-05-16 …
求帮助C语言作业,第四题一点思路都没有每题50金币,会追加题目1字符串简单加密将输入的字符串(只含 2020-06-09 …
谁知道小学五年级下册第十八课课后题第二小题答案人教版小学五年级第18课课后题第2小题默读课文,给三 2020-06-10 …
根据要求,发表意见。1.给《小英雄雨来》的每部分各加一个小标题。根据要求,发表意见。1.给《小英雄雨 2020-11-05 …
一道小学题有甲乙两位同学计算一道加法题甲计算正确结果为685乙计算错误结果是460乙错的原因一道小学 2020-11-06 …
求:黄冈小状元数学附加题答案(用小学方法哦),谢求:黄冈小状元分类专项复习卷六附加题答案(用小学方法 2020-11-12 …
三年级上册英才教程第125页附加题第一小题和第二小题第125页附加题第一小题甲、乙、丙三名同学共有彩 2020-11-15 …
六年级数学难题高手请当零食新手请当附加题啊四个小组加工一批零件.第一小组所做的等于其他小组所做的三分 2020-12-27 …