早教吧作业答案频道 -->化学-->
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质
题目详情
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.
(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1.
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线.
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种2高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___.
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液的pH等于___(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4,则N2H4(l)的标准燃烧热△H=___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸. 实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释.

(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1.
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线.
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种2高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___.
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液的pH等于___(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4,则N2H4(l)的标准燃烧热△H=___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸. 实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释.
▼优质解答
答案和解析
(1)①0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=
=0.45mol/L;
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=
=0.555mol/L,
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为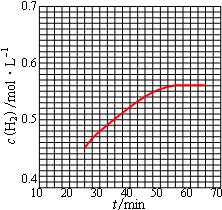 ;
;
故答案为: ;
;
②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
=
=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=
△H2-△H1-
△H4;
故答案为:
△H2-△H1-
△H4;
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
最后一问少了流程图,请填上谢谢,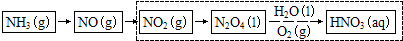
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=
| 0.9mol |
| 2L |
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=
| 1.11mol |
| 2L |
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为
 ;
;故答案为:
 ;
;②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
| c(N2H5+)×c(OH-) |
| c(N2H4) |
| c2(OH-) |
| 0.01 |
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:
| 3 |
| 2 |
| 1 |
| 2 |
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
最后一问少了流程图,请填上谢谢,
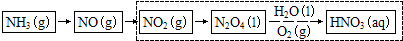
看了 氨气及其相关产品是基本化工原...的网友还看了以下:
为什么300除以0.85要比300乘以(1+15%)的结果要高?300是成本价,为什么除以0.85 2020-05-13 …
下面说法中,正确的是[]A.因为负数没有平方根,所以不论a取任何值,都无意义B.因为02=0,(- 2020-05-14 …
在平面直角坐标系中,0为坐标原点,以0为圆心的圆与直线x-根号3y-4=0相切在平面直角坐标系中, 2020-05-16 …
数学初二提问2次根式除法、√1.√3A平方B除以√4AB平方2.√4X三次方除以(-√X/4)3. 2020-05-23 …
小斌现有的钱再添1.5元刚好可以买一本3.75元的书和一支0.3元的铅笔,但他只买了一本2元的书, 2020-06-20 …
1.最近的一项统计结果表明,本市65岁以上老年人口所占比率为14.7%,老年人口协会欲对此统计结果 2020-06-30 …
统计学计算题从一批灯泡中抽取36个样本,测得样本平均数1900小时,样本标准差300小时,以ɑ=0 2020-08-03 …
联合国调查显示:犹太人,平均每人一年读书64本,韩国人,平均每人一年读书11本,法国人,平均每人一年 2020-11-01 …
从平地测的山高300米,平地高出海平面50米,若以平地为基准(平地位0米)则山高记多少米?若以海平面 2020-11-02 …
Log0.5x(x(2))-14log16x(x(3))+40log4x(1x)=0求x.不好意思, 2021-01-22 …