早教吧作业答案频道 -->化学-->
草酸亚铁为黄色固体,作为一种化工原料,可广泛用于涂料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产.合成草酸亚铁的流程如下:(1)配制(NH4)2Fe(SO4)2•6H2O溶
题目详情
草酸亚铁为黄色固体,作为一种化工原料,可广泛用于涂料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产.合成草酸亚铁的流程如下:
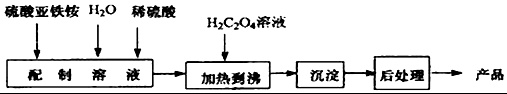
(1)配制(NH4)2Fe(SO4)2•6H2O溶液时,需加入少量稀硫酸,目的是___.
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是___.
(3)将制得的产品(FeC2O4•2H2O)在氩气气氛中进行加热分解,结果如图(TG%表示残留固体质量占原样品总质量的百分数).
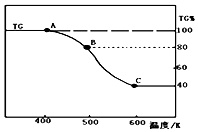
①则A-B发生反应的化学方程式为___;
②已知B→C过程中有等物质的量的两种气态氧化物生 成,写出B→C的化学方程式___;
(4)某草酸亚铁样品中含有少量草酸铵.为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容.
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL.
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,过滤,
Ⅳ.洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液体积V2mL.
回答下列问题:
①已知:草酸(H2C2O4)与酸性高锰酸钾溶液反应,现象是有气泡产生,紫色消失,写出该反应的离子方程式:___;
②若省略步骤Ⅳ,则测定的草酸根离子含量___(填“偏大”“偏小”“不变”)
③m g样品中草酸根离子的物质的量为___(用c,V1,V2的式子表示,不必化简)

(1)配制(NH4)2Fe(SO4)2•6H2O溶液时,需加入少量稀硫酸,目的是___.
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是___.
(3)将制得的产品(FeC2O4•2H2O)在氩气气氛中进行加热分解,结果如图(TG%表示残留固体质量占原样品总质量的百分数).

①则A-B发生反应的化学方程式为___;
②已知B→C过程中有等物质的量的两种气态氧化物生 成,写出B→C的化学方程式___;
(4)某草酸亚铁样品中含有少量草酸铵.为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容.
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL.
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,过滤,
Ⅳ.洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液体积V2mL.
回答下列问题:
①已知:草酸(H2C2O4)与酸性高锰酸钾溶液反应,现象是有气泡产生,紫色消失,写出该反应的离子方程式:___;
②若省略步骤Ⅳ,则测定的草酸根离子含量___(填“偏大”“偏小”“不变”)
③m g样品中草酸根离子的物质的量为___(用c,V1,V2的式子表示,不必化简)
▼优质解答
答案和解析
(1)溶液中亚铁离子是弱碱阳离子,水解显酸性,加入少量硫酸,抑制亚铁离和NH4+子水解,
故答案为:抑制Fe2+和NH4+水解;
(2)洗涤操作的具体方法为:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;检验是否洗涤干净的方法是取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净,
故答案为:取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(3)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4•2H2O加热失去结晶水,反应方程式为FeC2O4•2H2O
FeC2O4+2H2O,
故答案为:FeC2O4•2H2O
FeC2O4+2H2O;
②由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,依据氧化还原反应电子守恒分析计算,碳元素化合价从+3价变化为+2价和+3价,生成一氧化碳和二氧化碳气体,原子守恒配平写出化学方程式;FeC2O4
FeO+CO↑+CO2↑;故答案为:FeC2O4
FeO+CO↑+CO2↑↑;
(4)①发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
②根据以上分析,若省略步骤Ⅳ,则使二价铁离子偏少,所以消耗高锰酸钾溶液的体积也V2 偏小,则氧化草酸根消耗高锰酸钾溶液的体积为(V1-V2 )mL偏大,所以测定的草酸根离子含量也偏大,故答案为:偏大;
③根据以上分析,氧化草酸根消耗高锰酸钾溶液的体积为(V1-V2 )mL,又2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O,所以mg样品中草酸根离子的物质的量为c(V1-V2)×10-3×
×
=c(V1-V2)×10-3×
mol,
故答案为:c(V1-V2)×10-3×
mol.
故答案为:抑制Fe2+和NH4+水解;
(2)洗涤操作的具体方法为:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;检验是否洗涤干净的方法是取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净,
故答案为:取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(3)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
| 36 |
| 180 |
| ||
故答案为:FeC2O4•2H2O
| ||
②由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,依据氧化还原反应电子守恒分析计算,碳元素化合价从+3价变化为+2价和+3价,生成一氧化碳和二氧化碳气体,原子守恒配平写出化学方程式;FeC2O4
| ||
| ||
(4)①发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
②根据以上分析,若省略步骤Ⅳ,则使二价铁离子偏少,所以消耗高锰酸钾溶液的体积也V2 偏小,则氧化草酸根消耗高锰酸钾溶液的体积为(V1-V2 )mL偏大,所以测定的草酸根离子含量也偏大,故答案为:偏大;
③根据以上分析,氧化草酸根消耗高锰酸钾溶液的体积为(V1-V2 )mL,又2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O,所以mg样品中草酸根离子的物质的量为c(V1-V2)×10-3×
| 5 |
| 2 |
| 100mL |
| 20mL |
| 25 |
| 2 |
故答案为:c(V1-V2)×10-3×
| 25 |
| 2 |
看了 草酸亚铁为黄色固体,作为一种...的网友还看了以下:
有一包固体,可能含有、、、、NaCl、NaOH中的一种或几种。根据下列实验回答问题:(1)取少量固 2020-05-02 …
有一包固体粉末,可能是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成,为了分析固 2020-05-02 …
人民币防伪常使用一种胆固醇(C27H46O)液晶油墨,它受自然光照射时能改变颜色.下列关于胆固醇的 2020-05-15 …
人民币防伪常使用一种胆固醇(C27H46O)液晶油墨,它受自然光照射时能改变颜色.下列关于胆固醇的 2020-05-15 …
实验室常见的两种装置一种是固体与固体需要加热一种是固体与液体不需要加热都是产生气体要说明原理写出文 2020-05-17 …
比较下列几种粒子的构成,回答下列问题,已知粒子为NH3、H2O、SO2三种分子,NH4+、SO32 2020-05-23 …
制取气体发生装置智取气体的发生装置两种,一种是固体和液体接触及反应的制气装置,一种是------- 2020-05-24 …
取一定量的碳酸钠和碳酸氢钠固体混合加热至无气体放出为止,称得加热后剩余固体质量比原来少了6.2g, 2020-07-17 …
人民币防伪常使用一种胆固醇(C27H46O)液晶油墨,它受自然光照射时能改变颜色。下列关于胆固醇的说 2021-01-06 …
人民币防伪常使用一种胆固醇(C27H46O)液晶油墨,它受自然光照射时能改变颜色.下列关于胆固醇的说 2021-01-06 …