早教吧作业答案频道 -->化学-->
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.资料Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生氢气.Ⅱ.氢化钙要密封保存,一
题目详情
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
【资料】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生氢气.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
探究一:氢化钙与水反应的生成物
猜想一:氧化钙和氢气;猜想二:氢氧化钙和氢气.
(1)你认为猜想___错误,你的理由是___.
(2)CaH2中氢元素的化合价是___,写出CaH2与水反应的化学方程式___.
探究二:实验室制备氢化钙
用氢气与金属钙加热可得到氢化钙,实验装置和步骤如图所示:
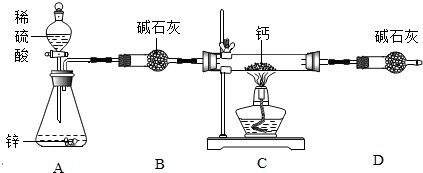
①检查装置气密性;②装入药品并打开分液漏斗;③加热反应一段时间;④停止加热,充分冷却;⑤关闭分液漏斗活塞.
(1)步骤①中检查气密性的方法是:___.
(2)装置B的作用是___;若要证明进入装置C的氢气已经干燥,应在___之间(填装置序号)增加装有___(试剂名称)的U型管.
(3)实验时先打开装置A中的活塞,一段时间后,再点燃装置C中的酒精灯,其目的是___.
(4)上述实验步骤存在安全隐患,有同学建议应先___再进行加热.
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验中确有CaH2生成.请你判断他的结论是否正确并说明理由___.
(6)经讨论,小组同学认为,可以通过固体质量的变化判断反应的发生.若反应前固体的质量为a,反应后固体的质量为b,a___b(填“>”“<”“=”),则说明反应发生.
探究三:产品含量测定
通过上述方法制得的氢化钙样品是否纯净?某兴趣小组的同学设计了几组实验进行验证.
甲组样品纯度的测定装置如图所示:A为发生装置,B为储液瓶,C为液体量瓶(有刻度).
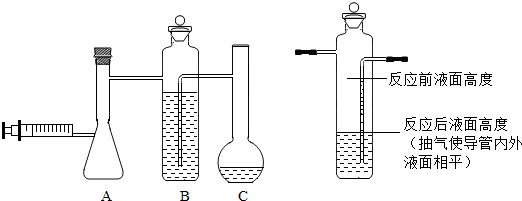
(1)实验前C中液体为120ml,实验时将注射器中100ml的水缓缓推入A装置,完全反应后,B中状况如图所示,再用注射器抽气使B中导管内外液面相平,最终C中液体为860ml,注射器中活塞停留在10mL处.则生成氢气___L.
(2)上述操作中抽气的原因是___.
乙组同学也采用测量氢气体积的方法来测定氢化钙的纯度.装置及步骤如图所示:
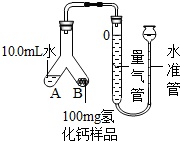
①检查装置气密性,装入药品;②调整水准管高度,使量气装置两边的液面保持同一水平.读取液面所在的刻度数据为10.0mL;③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合.④反应结束,冷却至室温,调节两端液面齐平,再次读取液面所在刻度数据为110.0mL.
(3)如何判断样品与水完全反应:___.
(4)读取量气管读数时,除了调节量气管和水准管的液面相平,还需视线与___相平.
(5)已知该条件下,氢气的密度为0.09mg/cm3.样品中氢化钙的纯度为___.(精确到0.1%)
丙组同学取乙组完全反应后的Y形管继续实验.
(6)观察管内有较多白色不溶物,请分析不溶物的成分为___(填写化学式),其不溶的原因的是___.
丙组同学向Y型管中滴加稀盐酸至pH=4,蒸干反应后的液体称量所得固体的质量,由此计算氢化钙的纯度.
滴加盐酸至pH=4的目的是___.
(7)该组某同学提出只要称量Y形管反应前后的质量差,也能计算氢化钙的纯度.你认为该方法是否准确并说明理由:___.
【资料】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生氢气.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
探究一:氢化钙与水反应的生成物
猜想一:氧化钙和氢气;猜想二:氢氧化钙和氢气.
(1)你认为猜想___错误,你的理由是___.
(2)CaH2中氢元素的化合价是___,写出CaH2与水反应的化学方程式___.
探究二:实验室制备氢化钙
用氢气与金属钙加热可得到氢化钙,实验装置和步骤如图所示:

①检查装置气密性;②装入药品并打开分液漏斗;③加热反应一段时间;④停止加热,充分冷却;⑤关闭分液漏斗活塞.
(1)步骤①中检查气密性的方法是:___.
(2)装置B的作用是___;若要证明进入装置C的氢气已经干燥,应在___之间(填装置序号)增加装有___(试剂名称)的U型管.
(3)实验时先打开装置A中的活塞,一段时间后,再点燃装置C中的酒精灯,其目的是___.
(4)上述实验步骤存在安全隐患,有同学建议应先___再进行加热.
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验中确有CaH2生成.请你判断他的结论是否正确并说明理由___.
(6)经讨论,小组同学认为,可以通过固体质量的变化判断反应的发生.若反应前固体的质量为a,反应后固体的质量为b,a___b(填“>”“<”“=”),则说明反应发生.
探究三:产品含量测定
通过上述方法制得的氢化钙样品是否纯净?某兴趣小组的同学设计了几组实验进行验证.
甲组样品纯度的测定装置如图所示:A为发生装置,B为储液瓶,C为液体量瓶(有刻度).

(1)实验前C中液体为120ml,实验时将注射器中100ml的水缓缓推入A装置,完全反应后,B中状况如图所示,再用注射器抽气使B中导管内外液面相平,最终C中液体为860ml,注射器中活塞停留在10mL处.则生成氢气___L.
(2)上述操作中抽气的原因是___.
乙组同学也采用测量氢气体积的方法来测定氢化钙的纯度.装置及步骤如图所示:

①检查装置气密性,装入药品;②调整水准管高度,使量气装置两边的液面保持同一水平.读取液面所在的刻度数据为10.0mL;③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合.④反应结束,冷却至室温,调节两端液面齐平,再次读取液面所在刻度数据为110.0mL.
(3)如何判断样品与水完全反应:___.
(4)读取量气管读数时,除了调节量气管和水准管的液面相平,还需视线与___相平.
(5)已知该条件下,氢气的密度为0.09mg/cm3.样品中氢化钙的纯度为___.(精确到0.1%)
丙组同学取乙组完全反应后的Y形管继续实验.
(6)观察管内有较多白色不溶物,请分析不溶物的成分为___(填写化学式),其不溶的原因的是___.
丙组同学向Y型管中滴加稀盐酸至pH=4,蒸干反应后的液体称量所得固体的质量,由此计算氢化钙的纯度.
滴加盐酸至pH=4的目的是___.
(7)该组某同学提出只要称量Y形管反应前后的质量差,也能计算氢化钙的纯度.你认为该方法是否准确并说明理由:___.
▼优质解答
答案和解析
探究一:(1)我认为猜想一错误,理由是:根据水中氢原子和氧原子的个数比不符;
(2)钙元素通常显示+2价,所以CaH2中氢元素的化合价是-1价,氢化钙和水反应生成氢氧化钙和氢气,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
探究二:(1)步骤①中检查气密性的方法是:关闭分液漏斗的活塞,先把导管的一端放入水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;
(2)碱石灰有吸水性,所以装置B的作用是:吸水干燥作用,无水硫酸铜遇水显蓝色,所以要证明进入装置C的氢气已经干燥,应在BC之间增加装有无水硫酸铜的U型管,观察白色的硫酸铜是否变蓝色,如果不变色,证明氢气比较干燥;
(3)氢气和氧气的混合气点燃,可能发生爆炸,所以实验时先打开装置A中的活塞,一段时间后,再点燃装置C中的酒精灯,其目的是:排出空气,避免爆炸;
(4)给玻璃装置加热之前需要先预热,所以上述实验步骤存在安全隐患,有同学建议应先预热,再进行加热,防止受热不均,试管炸裂;
(5)上述实验中确有CaH2生成不正确,因为氢化钙与水反应生成氢氧化钙和氢气,钙与水剧烈反应也生成氢氧化钙,同时产生氢气;都生成氢氧化钙,氢氧化钙显碱性,因此滴入酚酞后显红色;
(6)氢气和钙加热会生成氢化钙,所以可以通过固体质量的变化判断反应的发生,若反应前固体的质量为a,反应后固体的质量为b,如果a探究三:(1)通过分析C装置中水的体积和注射器内活塞的位置可知,生成氢气的体积为:(860mL+10mL-120mL)×
=0.75L;
(2)抽气可以产生压力差,使生成的氢气全部进入锥形瓶中,从而正确称量排出水的体积,所以上述操作中抽气的原因是:将生成的氢气全部吸入锥形瓶中;
(3)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(4)读取量气管读数时,除了调节量气管和水准管的液面相平,还需视线与凹液面最低处相平;
(5)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是x,生成氢气质量为y,则钙的质量为100mg-x,钙与水反应生成氢气质量为9mg-y,则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x y
=
,解得y=
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-x 9mg-y
=
将y=
代入,解得x=88.4mg
所以样品中氢化钙的纯度为:
×100%=88.4%;
(6)氢氧化钙在水中的溶解度较小,氢氧化钙溶解度随温度的影响升高而减小,氢化钙和水反应生成氢氧化钙和氢气放出热量,所以观察管内有较多白色不溶物,该不溶物的成分为Ca(OH)2,其不溶的原因的是:氢化钙和水反应放出大量的热,氢氧化钙在水中的溶解度随温度的升高而减小,且氢氧化钠在水中的溶解度较小,丙组同学向Y型管中滴加稀盐酸至pH=4,蒸干反应后的液体称量所得固体的质量,由此计算氢化钙的纯度,滴加盐酸至pH=4的目的是:将氢氧化钙全部转化成氯化钙;
(7)氢化钙和水反应放出热量,氢气会携带水蒸气进入量气管中,所以该方法不准确,理由是:氢化钙和水反应放出大量的热,一定量的水蒸气会进入量气管,是Y型管内的质量差偏大.
故答案为:探究一:(1)一,根据水中氢原子和氧原子的个数比不符;
(2)-1,CaH2+2H2O=Ca(OH)2+2H2↑;
探究二:(1)关闭分液漏斗的活塞,先把导管的一端放入水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;
(2)吸水干燥作用,BC,无水硫酸铜;
(3)排出空气,避免爆炸;
(4)预热;
(5)不正确,因为氢化钙与水反应生成氢氧化钙和氢气,钙与水剧烈反应也生成氢氧化钙,同时产生氢气;都生成氢氧化钙,氢氧化钙显碱性,因此滴入酚酞后显红色;
(6)<;
探究三:(1)0.75;
(2)将生成的氢气全部吸入锥形瓶中;
(3)量气管中液面不再变化;
(4)凹液面最低处;
(5)88.4%;
(6)Ca(OH)2,氢化钙和水反应放出大量的热,氢氧化钙在水中的溶解度随温度的升高而减小,且氢氧化钠在水中的溶解度较小;将氢氧化钙全部转化成氯化钙;
(7)不准确,氢化钙和水反应放出大量的热,一定量的水蒸气会进入量气管,是Y型管内的质量差偏大.
(2)钙元素通常显示+2价,所以CaH2中氢元素的化合价是-1价,氢化钙和水反应生成氢氧化钙和氢气,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
探究二:(1)步骤①中检查气密性的方法是:关闭分液漏斗的活塞,先把导管的一端放入水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;
(2)碱石灰有吸水性,所以装置B的作用是:吸水干燥作用,无水硫酸铜遇水显蓝色,所以要证明进入装置C的氢气已经干燥,应在BC之间增加装有无水硫酸铜的U型管,观察白色的硫酸铜是否变蓝色,如果不变色,证明氢气比较干燥;
(3)氢气和氧气的混合气点燃,可能发生爆炸,所以实验时先打开装置A中的活塞,一段时间后,再点燃装置C中的酒精灯,其目的是:排出空气,避免爆炸;
(4)给玻璃装置加热之前需要先预热,所以上述实验步骤存在安全隐患,有同学建议应先预热,再进行加热,防止受热不均,试管炸裂;
(5)上述实验中确有CaH2生成不正确,因为氢化钙与水反应生成氢氧化钙和氢气,钙与水剧烈反应也生成氢氧化钙,同时产生氢气;都生成氢氧化钙,氢氧化钙显碱性,因此滴入酚酞后显红色;
(6)氢气和钙加热会生成氢化钙,所以可以通过固体质量的变化判断反应的发生,若反应前固体的质量为a,反应后固体的质量为b,如果a
| 1 |
| 1000 |
(2)抽气可以产生压力差,使生成的氢气全部进入锥形瓶中,从而正确称量排出水的体积,所以上述操作中抽气的原因是:将生成的氢气全部吸入锥形瓶中;
(3)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(4)读取量气管读数时,除了调节量气管和水准管的液面相平,还需视线与凹液面最低处相平;
(5)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是x,生成氢气质量为y,则钙的质量为100mg-x,钙与水反应生成氢气质量为9mg-y,则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x y
| 42 |
| x |
| 4 |
| y |
| 2x |
| 21 |
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-x 9mg-y
| 40 |
| 100mg-x |
| 2 |
| 9mg-y |
将y=
| 2x |
| 21 |
所以样品中氢化钙的纯度为:
| 88.4mg |
| 100mg |
(6)氢氧化钙在水中的溶解度较小,氢氧化钙溶解度随温度的影响升高而减小,氢化钙和水反应生成氢氧化钙和氢气放出热量,所以观察管内有较多白色不溶物,该不溶物的成分为Ca(OH)2,其不溶的原因的是:氢化钙和水反应放出大量的热,氢氧化钙在水中的溶解度随温度的升高而减小,且氢氧化钠在水中的溶解度较小,丙组同学向Y型管中滴加稀盐酸至pH=4,蒸干反应后的液体称量所得固体的质量,由此计算氢化钙的纯度,滴加盐酸至pH=4的目的是:将氢氧化钙全部转化成氯化钙;
(7)氢化钙和水反应放出热量,氢气会携带水蒸气进入量气管中,所以该方法不准确,理由是:氢化钙和水反应放出大量的热,一定量的水蒸气会进入量气管,是Y型管内的质量差偏大.
故答案为:探究一:(1)一,根据水中氢原子和氧原子的个数比不符;
(2)-1,CaH2+2H2O=Ca(OH)2+2H2↑;
探究二:(1)关闭分液漏斗的活塞,先把导管的一端放入水中,然后两手紧握锥形瓶的外壁,观察导管口是否有气泡冒出;
(2)吸水干燥作用,BC,无水硫酸铜;
(3)排出空气,避免爆炸;
(4)预热;
(5)不正确,因为氢化钙与水反应生成氢氧化钙和氢气,钙与水剧烈反应也生成氢氧化钙,同时产生氢气;都生成氢氧化钙,氢氧化钙显碱性,因此滴入酚酞后显红色;
(6)<;
探究三:(1)0.75;
(2)将生成的氢气全部吸入锥形瓶中;
(3)量气管中液面不再变化;
(4)凹液面最低处;
(5)88.4%;
(6)Ca(OH)2,氢化钙和水反应放出大量的热,氢氧化钙在水中的溶解度随温度的升高而减小,且氢氧化钠在水中的溶解度较小;将氢氧化钙全部转化成氯化钙;
(7)不准确,氢化钙和水反应放出大量的热,一定量的水蒸气会进入量气管,是Y型管内的质量差偏大.
看了 氢化钙(CaH2)是一种常用...的网友还看了以下:
在“比较过氧化氢在不同条件下的分解”实验中用新鲜肝脏的目的是()A.有利于过氧化氢酶的释放B.含有 2020-05-12 …
下列有关叙述正确的是()A.液化、汽化、风化、熔化等都属于物理变化B.液化石油气、汽油、花生油主要 2020-05-13 …
为什么Fe3+和过氧化氢促使过氧化氢分解,是降低活化能?分子从常态转为容易发生化学反应的活跃状态所 2020-05-20 …
为什么Fe3+和过氧化氢促使过氧化氢分解,是降低活化能?分子从常态转为容易发生化学反应的活跃状态所 2020-05-20 …
CaH2中的氢元素呈负一价.CaH2+H2O=Ca(OH)2+2h2其中水是还原剂还是氧化剂或者都 2020-06-27 …
(2011•百色模拟)对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有以下判断:①H2只是 2020-06-27 …
(2011•百色模拟)对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有以下判断:①H2只是 2020-06-27 …
氢气是很好的能源物质,但不便于储存和运输.CaH2是一种储氢材料,其储存和释放氢气的过程如图所示( 2020-07-13 …
《走向高考2012》生物39页典例1:加热使过氧化氢分子能量提高,酶不影响过氧化氢分子能量.为什么是 2020-11-07 …
某些金属氢化物与水反应可生成碱和氢气,如CaH2+2H2O═Ca(OH)2+2H2↑,NaH与CaH 2021-01-22 …