早教吧作业答案频道 -->化学-->
海水开发利用的部分过程如图所示.(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为.(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生
题目详情
海水开发利用的部分过程如图所示.
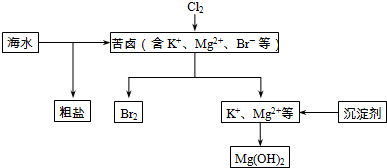
(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为___.
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为___.也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1mol Br2时,转移的电子为___mol.
(3)下列有关海水综合利用的说法错误的是___.
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用NaOH作为沉淀剂
D.海水提镁涉及到复分解反应.

(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为___.
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为___.也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1mol Br2时,转移的电子为___mol.
(3)下列有关海水综合利用的说法错误的是___.
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用NaOH作为沉淀剂
D.海水提镁涉及到复分解反应.
▼优质解答
答案和解析
(1)向苦卤中通入Cl2置换出溴单质,分离得到溴,通入Cl2是为了提取溴,分液的离子方程式为:Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(2)海水提取溴一般用氯气置换溴离子转化为溴单质,溴单质沸点低,易挥发,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,用SO2的水溶液将其还原吸收,发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,纯碱吸收溴单质,溴元素化合价0价变化为-1价和+5价,电子转移5e-,配平得到3Br2+6Na2CO3+3H2O→5NaBr+NaBrO3+6NaHCO3,反应中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×
×5=
mol,
故答案为:
;
(3)A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,故A正确;
B.电解饱和食盐水生成的是氯气、氢气和氢氧化钠,电解熔融氯化钠生成钠和氯气,故B错误;
C.氢氧化钠是强碱,具有强腐蚀性价格高,工业生产中常选用生石灰或石灰水作沉淀剂,故C错误;
D.海水提镁,涉及生成氢氧化镁、氢氧化镁与盐酸反应,生成氯化镁电解可生成镁,涉及复分解反应,故D正确.
故答案为:BC.
(2)海水提取溴一般用氯气置换溴离子转化为溴单质,溴单质沸点低,易挥发,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,用SO2的水溶液将其还原吸收,发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,纯碱吸收溴单质,溴元素化合价0价变化为-1价和+5价,电子转移5e-,配平得到3Br2+6Na2CO3+3H2O→5NaBr+NaBrO3+6NaHCO3,反应中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×
| 1 |
| 1+5 |
| 5 |
| 3 |
故答案为:
| 5 |
| 3 |
(3)A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,故A正确;
B.电解饱和食盐水生成的是氯气、氢气和氢氧化钠,电解熔融氯化钠生成钠和氯气,故B错误;
C.氢氧化钠是强碱,具有强腐蚀性价格高,工业生产中常选用生石灰或石灰水作沉淀剂,故C错误;
D.海水提镁,涉及生成氢氧化镁、氢氧化镁与盐酸反应,生成氯化镁电解可生成镁,涉及复分解反应,故D正确.
故答案为:BC.
看了 海水开发利用的部分过程如图所...的网友还看了以下:
3道简单的高二化学题1·在一支25mL酸式滴定管中盛入0.1mol/L的HCl溶液,其液面恰好在5 2020-05-17 …
英语翻译1.操作者先把脚部伸入皮套恐龙足部,用橡皮绷带将脚部与恐龙足部扎紧,让人脚与恐龙足部实现精 2020-05-17 …
将镁在空气中燃烧的全部产物溶解在80ml浓度为2.375mol/L盐酸中,用40ml0.8mol/ 2020-06-12 …
把长为l的铁钉钉入木板中,每打击一次给予的能量为E0,已知钉子在木板中遇到的阻力与钉子进入木板的深 2020-06-15 …
称取0.5000g煤样,将其中硫完全氧化为SO42-并全部进入溶液,除去干扰离子后,加入0.050 2020-06-22 …
物理变力做功要把长为L的铁钉钉入木板中,设每打击一次,锤子对钉子做的功均为W,已知钉子在木板中受到的 2020-10-30 …
认为自己物理NB的进有一重为27N的长方体物体,长L=20cm,其横截面积S1是盛水容器横截面积S2 2020-11-21 …
刘老师上月支出情况如下:生活费用占全部收入的1/3,教育费用及水电费用占全部收入的1/4,其余的存入 2020-11-25 …
用L,l,m表示k某种弹簧秤原来的长度为l,悬挂重物后的长度L可用公式L=l+k分之m表示某种弹簧秤 2020-12-05 …
使用试管夹夹持试管时,正确的操作是()A.从试管口套入,夹在试管中部B.从试管口套入,夹在试管中上部 2020-12-19 …