早教吧作业答案频道 -->化学-->
甲酸(HCOOH)熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,具有较强的还原性.加热至160℃即分解成二氧化碳和氢气.(1)实验室中向加热至80℃-90℃的浓硫酸中逐滴滴入甲酸,再缓慢加热可
题目详情
甲酸(HCOOH)熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,具有较强的还原性.加热至160℃即分解成二氧化碳和氢气.
(1)实验室中向加热至80℃-90℃的浓硫酸中逐滴滴入甲酸,再缓慢加热可制得一氧化碳:HCOOH
H2O+CO↑,实验部分装置如图1所示.
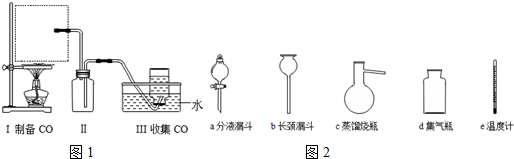
①请从图2中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:___、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于___位置.
②装置Ⅱ的作用是___.
(2)实验室可用甲酸、硫酸铜以及碳酸氢钠制备甲酸铜,相关化学方程式为:
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、制备碱式碳酸铜:NaHCO3固体,CuSO4•5H2O晶体
…→Cu(OH)2•CuCO3固体
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为:取最后一次洗涤液少许于试管中,滴加___,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净.
Ⅱ、制备甲酸铜:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2~3次,晾干,得到产品.
④“趁热过滤”中,必须“趁热”的原因是___.
⑤用乙醇洗涤晶体的目的是___.
(3)请设计实验证明甲酸具有较强的还原性:___.
(1)实验室中向加热至80℃-90℃的浓硫酸中逐滴滴入甲酸,再缓慢加热可制得一氧化碳:HCOOH
| ||
| 80℃-90℃ |

①请从图2中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:___、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于___位置.
②装置Ⅱ的作用是___.
(2)实验室可用甲酸、硫酸铜以及碳酸氢钠制备甲酸铜,相关化学方程式为:
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、制备碱式碳酸铜:NaHCO3固体,CuSO4•5H2O晶体
| i |
| |
| 研磨 |
| ii |
| |
| 热水中反应 |
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为:取最后一次洗涤液少许于试管中,滴加___,若不产生白色沉淀,说明沉淀已洗涤干净;若产生白色沉淀,说明沉淀未洗涤干净.
Ⅱ、制备甲酸铜:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的
| 1 |
| 3 |
④“趁热过滤”中,必须“趁热”的原因是___.
⑤用乙醇洗涤晶体的目的是___.
(3)请设计实验证明甲酸具有较强的还原性:___.
▼优质解答
答案和解析
(1)①该制备原理符合:液体+液体
气体,用分液漏斗添加甲酸,在蒸馏烧瓶中反应,且需控制反应的温度,温度计水银球应在液面以下,但不能接触烧瓶底部,
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:出现黑色固体;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:滴加BaCl2溶液;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质,并减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,则说明甲酸具有较强的还原性.
| △ |
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:出现黑色固体;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:滴加BaCl2溶液;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质,并减少甲酸铜晶体的损失;
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,则说明甲酸具有较强的还原性.
看了 甲酸(HCOOH)熔点8.4...的网友还看了以下:
1.用什么方法可以得到铁水?比如说用煤碳加热温度是否能达到铁的熔点呢?还有就是用什么样的熔器可以存 2020-05-17 …
如果∠1与∠2互为补角,∠1>∠2,那么∠2的余角为A.1/2*(∠1+∠2)B.1/2∠1C.1 2020-06-02 …
物态变化问题水的熔点是0℃酒精的熔点是114℃那么等量的酒精和水的混合物的熔点是多少?这个熔点比酒 2020-06-13 …
钢的熔点高还是铁的熔点高?是用钢来炼铁,还是用铁来炼钢? 2020-06-20 …
古代怎么熔金的,金子的熔点很高.古代是用什么方法和燃料来使金子熔化的.还有银和其他金属. 2020-06-26 …
俗语说:"真金不怕火炼",那是金的熔点高还是铁的熔点高呢? 2020-07-08 …
已知x-1与y+1互为负倒数.求y的-1次方-x的-1次方的值已知x-1与y+1互为负倒数.求y的 2020-07-30 …
为何橡皮和塑料制品放在一起时间久了会“熔化”?是橡皮被塑料“熔化”了还是塑料被橡皮“熔化”了?如果不 2020-11-20 …
合金的熔点比各成分金属的熔点高还是低?硬度呢? 2020-12-03 …
工业上制取钠的方法是电解熔融NaCl还是用钾与NaCl共熔? 2021-02-05 …