早教吧作业答案频道 -->化学-->
甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性、较强的还原性.熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气.(1)实验室可用甲酸与
题目详情
甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性、较强的还原性.熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气.
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH
H2O+CO↑,实验的部分装置如下图所示.制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸.
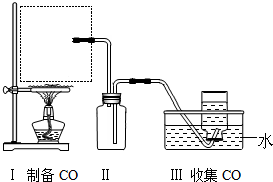
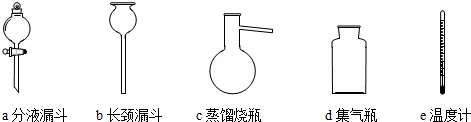
①请从图中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:___、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于___位置.
②装置Ⅱ的作用是___.
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.相关的化学方程式是:
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
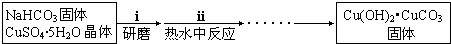
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为___.
Ⅱ、甲酸铜的制备:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2~3次,晾干,得到产品.
④“趁热过滤”中,必须“趁热”的原因是___.
⑤用乙醇洗涤晶体的目的是___.
(3)请设计实验证明甲酸具有较强的还原性:___.
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH
| ||
| 80℃-90℃ |

①请从图中挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:___、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于___位置.

②装置Ⅱ的作用是___.
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.相关的化学方程式是:
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
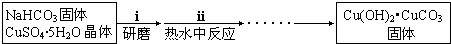
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为___.
Ⅱ、甲酸铜的制备:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的
| 1 |
| 3 |
④“趁热过滤”中,必须“趁热”的原因是___.
⑤用乙醇洗涤晶体的目的是___.
(3)请设计实验证明甲酸具有较强的还原性:___.
▼优质解答
答案和解析
(1)①该制备原理符合:液体+液体
气体,用分液漏斗添加甲酸,在蒸馏烧瓶中反应,且需控制反应的温度,温度计水银球应在液面以下,但不能接触烧瓶底部,
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:有黑色固体生成;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质.
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成.
| △ |
故答案为:ac;液面以下,但不能接触烧瓶底部;
②生成的气体中含有HCOOH,HCOOH易溶于水,B起安全瓶作用,防止水因倒吸而流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中;
(2)①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是:研细并混合均匀,使反应充分,
故答案为:研细并混合均匀;
②温度过高,碱式碳酸铜会分解生成黑色的CuO,
故答案为:有黑色固体生成;
③碱式碳酸铜表面会附着硫酸根离子,检验洗涤干净方法:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净,
故答案为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净;
④甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,防止甲酸铜晶体析出,
故答案为:防止甲酸铜晶体析出;
⑤甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的水及其它杂质,减少甲酸铜晶体的损失,
故答案为:洗去晶体表面的水和其它杂质.
(3)甲酸能发生银镜反应,可以证明甲酸具有还原性,具体实验方案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成,
故答案为:往甲酸溶液中滴加氢氧化钠溶液调成碱性.再取该溶液几滴滴加到2mL新制银氨溶液中,水浴加热,有银镜生成.
看了 甲酸(HCOOH)是一种有刺...的网友还看了以下:
熔浆是液体为什么却会燃烧如果在高温情况下熔浆里的水分不就蒸发了么那为什么熔浆还是液体有火焰成液体的 2020-04-27 …
常用温度计是根据液体的原理制成的,里面的液体有的用酒精,有的用水银.已知酒精和水银的熔点和沸点如图 2020-05-14 …
常用温度计是根据液体的原理制成的,里面的液体有的用酒精,有的用水银.已知酒精和水银的熔点和沸点如图 2020-05-14 …
常用温度计是根据液体热胀冷缩的原理制成的,里面的液体有的用酒精,有的用水银.已知酒精和水银的熔点和 2020-05-14 …
常用温度计是根据测温液体的原理制成的.里面的液体有的用酒精,有的用水银.已知酒精和水银的熔点和沸点 2020-05-14 …
物质水银酒精甲苯铅萘熔点-38.8-117-9532880.5沸点35778.5111174021 2020-07-19 …
已知A、B、C、D四种物质具有以下物理性质:ABCD分散到水中得悬浊液得无色溶液液体分层,且下层为 2020-07-26 …
如何将高熔点的蜡粉做成水乳液现有的蜡粉熔点比较高,105左右,现想把它做成水乳液.我采用了两种方法, 2020-11-05 …
现有四组分散系:①汽油和水形成的乳浊液②含有泥沙的食盐水③溶有碘(I2)的碘化钾溶液④乙二醇和丙三醇 2021-01-22 …
下列叙述不正确的是()A.混合物没有固定的组成,所以混合物没有固定的熔沸点B.H2SO4只有在水溶液 2021-02-05 …