早教吧作业答案频道 -->化学-->
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4•2H2O.(1)CaSO4•2H2O脱水反应相关的热化学方程式为:CaSO4•2H2O(s)═CaSO4•12H2O(s)+32H2O
题目详情
磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4•2H2O.
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=83.2kJ•mol-1
CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
H2O(g)=H2O(l)△H3=-44kJ•mol-1
则反应CaSO4•
H2O(s)═CaSO4(s)+
H2O(g)的△H4=___kJ•mol-1.
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.
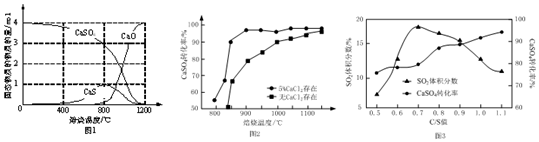
①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___;高于800℃时主要发生的反应的化学方程式为___.
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
③以C作还原剂,向密闭容器中加入相同质量的几组不同
值(炭粉与CaSO4的物质的量之比)的混合物在1100℃加热,结果如图3所示.当
值为0.5时,反应产物为CaO、SO2和CO2;当
值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___.
(3)已知Ksp(CaSO4)=7.10×10-5,Ksp(CaCO3)=6.2125×10-7,利用反应CaSO4(s)+(NH4)2CO3(aq)⇌CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵.若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,此时溶液中c(CO32-)=___.
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
| 1 |
| 2 |
| 3 |
| 2 |
CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
H2O(g)=H2O(l)△H3=-44kJ•mol-1
则反应CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.

①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___;高于800℃时主要发生的反应的化学方程式为___.
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
③以C作还原剂,向密闭容器中加入相同质量的几组不同
| C |
| S |
| C |
| S |
| C |
| S |
(3)已知Ksp(CaSO4)=7.10×10-5,Ksp(CaCO3)=6.2125×10-7,利用反应CaSO4(s)+(NH4)2CO3(aq)⇌CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵.若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,此时溶液中c(CO32-)=___.
▼优质解答
答案和解析
(1)已知①CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=83.2kJ•mol-1
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
将②-③×2-①得CaSO4•
H2O(s)═CaSO4(s)+
H2O(g),则△H4=[26kJ•mol-1-(-44kJ•mol-1)×2-83.2kJ•mol-1]=30.8kJ•mol-1,
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
4CaO+4SO2↑,氧化钙的物质的量增加,硫化钙的物质的量减小,
故答案为:CaS;CaS+3CaSO4
4CaO+4SO2↑;
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动;
③当
值大于0.7时,高温下,过量的C与CO2反应生成CO气体,反应产物为CaO、SO2和CO2、CO,使气体总体积增大,也可能硫酸钙部分转化为其他含硫物质,
故答案为:高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)⇌SO42-(aq)+CaCO3(s),若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,已知Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,c(Ca2+)=3.55×10-5mol•L-1,Ksp(CaCO3)=6.2125×10-7,Ksp(CaCO3)=c(Ca2+)×c(CO32-),c(CO32-)=1.75×10-2 mol•L-1,
故答案为:1.75×10-2 mol•L-1.
| 1 |
| 2 |
| 3 |
| 2 |
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
将②-③×2-①得CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
| ||
故答案为:CaS;CaS+3CaSO4
| ||
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动;
③当
| C |
| S |
故答案为:高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)⇌SO42-(aq)+CaCO3(s),若反应达到平衡后溶液中c(SO42-)=2.0mol•L-1,已知Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,c(Ca2+)=3.55×10-5mol•L-1,Ksp(CaCO3)=6.2125×10-7,Ksp(CaCO3)=c(Ca2+)×c(CO32-),c(CO32-)=1.75×10-2 mol•L-1,
故答案为:1.75×10-2 mol•L-1.
看了 磷石膏是湿法生产磷酸排出的工...的网友还看了以下:
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
进行下列数的数制转换(213)D=()B=()H=()O(69.625)D=()B=()H=()O 2020-05-21 …
窈窕淑女,君子好逑中的好是读hǎo还是hào呢窈窕淑女,君子好逑中的好是读hǎo还是hào原来一直 2020-05-22 …
变限积分求道问题对函数f(t+h)-f(t-h)在[-h,h]上的积分对h求导.F(h)=∫[-h 2020-05-23 …
什么是译音用字?我在字典里查“呵”字,出现下面结果:您查询的字是:呵?多音字:hē,hā,ā(一) 2020-06-12 …
如图,AB是圆O直径,C是弧AB的中点,圆O的切线BD交AC延长线与点D,E是OB的中点,CE延长 2020-06-15 …
已知:在△ABC中,以AC边为直径的⊙O交BC于点D,在劣弧AD上取一点E使∠EBC=∠DEC,延 2020-06-23 …
H-O-H,每mol水中含2molH-O键含2mol的H-O键,H-O-H中的H-O?H-O是什么 2020-06-28 …
进制换算(213)D=()B=()H=()O(69.625)D=()D=()B=()O(127)D 2020-07-19 …
用竖式计算,并验算.①6.8÷o.h②4.6÷1.h③h.4÷o.18④h.h8÷8.6⑤h.98 2020-07-29 …