早教吧作业答案频道 -->化学-->
磷石膏是在磷酸生产中用硫酸处理磷矿时产生的固体废渣,主要成分是CaSO4•2H2O,研究其综合利用对防止环境污染与资源浪费意义重大.回答下列问题:(1)CaSO4•2H2O脱水反应相关的热化学
题目详情
磷石膏是在磷酸生产中用硫酸处理磷矿时产生的固体废渣,主要成分是CaSO4•2H2O,
研究其综合利用对防止环境污染与资源浪费意义重大.回答下列问题:
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=+83.2kJ•mol-1
CaSO4•2H2O(s)═CaSO4(s)+
H2O(l)△H2=+26kJ•mol-1
H2O(g)═H2O(l)△H3-44kJ•mol-1
则反应CaSO4•
H2O(s)═CaSO4(s)+
H2O(g)的△H4=___.
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.
①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___(填化学式);高于800℃时主要发生的反应的化学方程式为___.
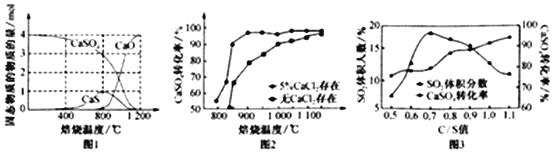
②以高硫煤为还原剂焙烧2.5小时.不同条件对硫化钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
研究其综合利用对防止环境污染与资源浪费意义重大.回答下列问题:
(1)CaSO4•2H2O脱水反应相关的热化学方程式为:
CaSO4•2H2O(s)═CaSO4•
| 1 |
| 2 |
| 3 |
| 2 |
CaSO4•2H2O(s)═CaSO4(s)+
| 3 |
| 2 |
H2O(g)═H2O(l)△H3-44kJ•mol-1
则反应CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
(2)用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.
①以CO作还原剂,改变反应温度可得到不同的产物.不同温度下反应后所得固体成分的物质的量如图1所示.在低于800℃时主要还原产物为___(填化学式);高于800℃时主要发生的反应的化学方程式为___.

②以高硫煤为还原剂焙烧2.5小时.不同条件对硫化钙转化率的影响如图2所示.CaCl2的作用是___;当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___.
▼优质解答
答案和解析
(1)已知①CaSO4•2H2O(s)═CaSO4•
H2O(s)+
H2O(g)△H1=+83.2kJ•mol-1
②CaSO4•2H2O(s)═CaSO4(s)+
H2O(l)△H2=+26kJ•mol-1
③H2O(g)═H2O(l)△H3-44kJ•mol-1
将②-③×2-①得CaSO4•
H2O(s)═CaSO4(s)+
H2O(g),则△H4=[26kJ•mol-1-(-44kJ•mol-1)×2-83.2kJ•mol-1]=30.8kJ•mol-1,
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
4CaO+4SO2↑,氧化钙的物质的量增加,硫化钙的物质的量减小,
故答案为:CaS;CaS+3CaSO4
4CaO+4SO2↑;
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动.
| 1 |
| 2 |
| 3 |
| 2 |
②CaSO4•2H2O(s)═CaSO4(s)+
| 3 |
| 2 |
③H2O(g)═H2O(l)△H3-44kJ•mol-1
将②-③×2-①得CaSO4•
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4
| ||
故答案为:CaS;CaS+3CaSO4
| ||
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动.
看了 磷石膏是在磷酸生产中用硫酸处...的网友还看了以下:
下列关于声现象的说法中,正确的是()A.声音可以在真空中传播B.在城区禁止汽车鸣笛,是在传播过程中 2020-04-09 …
下列有关水的描述中不正确的是()A.使用无磷洗衣粉有利于防止水体富营养化B.水是由氢原子和氧原子构 2020-05-13 …
人的身高长到一定程度后就不再长了,其原因是()A.软骨层骨化成骨B.生长激素停止分泌C.红骨髓转化 2020-05-13 …
阅读下面的短文,回答后面的问题.静止通信卫星真的“静止”吗?通信卫星在太空定居,与地球保持相对静止 2020-05-13 …
如图,粗糙水平面上,两物体A、B以轻绳相连,在恒力F作用下做匀速运动.某时刻轻绳断开,A在F牵引下 2020-05-13 …
2007年是内蒙古自治区成立60周年,以下内容中不符合史实的是A.成吉思汗曾率领蒙古军队到达过印度 2020-05-16 …
把一张纸片剪成4块,再从所得的纸片中任取若干块,每块又剪成4块,像这样依次地进行下去,到剪完某一次 2020-05-20 …
“掩耳盗铃”是大家非常熟悉的故事,从物理学角度分析盗贼所犯的错误是:既没有阻止声音的,又没有阻止声 2020-06-25 …
浅尝辄止然后是止开头的,4个音都可以,然后是成语,最后一个字必须是浅,4个音,看有多少就是止开头4 2020-06-30 …
法律终止生效是法律时间效力的一个重要问题。在以默示废止方式终止法律生效时,一般应当选择下列哪一原则 2020-07-05 …