已知H2R为二元弱酸:H2R⇌HR-+H+Ka1HR-⇌R2-+H+Ka2常温下,向某浓度的H2R溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2R、HR-、R2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示
已知H2R为二元弱酸:H2R⇌HR-+H+ Ka1 HR-⇌R2-+H+ Ka2
常温下,向某浓度的H2R溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2R、HR-、R2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )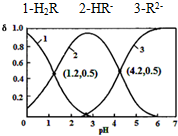
A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2R)
B. pH=2.7溶液中:c2(HR-)/[c(H2R)×c(R2-)]=1000
C. 将相同物质的量KHR和K2R固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
B、首先根据图中的1、2交点和2、3交点,结合二元弱酸:H2R⇌HR-+H+,Ka1=
| c(H+)c(HR-) |
| c(H2R) |
| c(H+)•c(R2-) |
| c(HR-) |
| Ka1 |
| Ka2 |
C、pH为4.2的混合液显示酸性,根据图示信息HR-、R2-的物质的量分数相等,各占一半,将相同物质的量KHR和K2R固体完全溶于水,R2-的水解程度较大,所以不可能得到符合条件的混合液,不能这样配得pH为4.2得溶液,故C错误;
D、pH=1.2溶液是KHR溶液,向pH=1.2的溶液中加KOH溶液,KHR溶液和KOH溶液之间会发生反应得到K2R,R2-的水解程度较大,对水的电离起到促进作用,水的电离程度一直增大,故D正确.
故选C.
有一盏40W的灯泡,正常情况下,一天使用5小时,问一天耗电量是多少度?如果每度电是0.535元,3 2020-04-07 …
任意温度都能自发进行的反应,升高温度,平衡常数如何变化?一个反应,在任意温度下都能自发进行,若升高 2020-04-27 …
在评论文章时有哪些什么角度进行描写一般文章中常用的什么角度描写?就是做题目时经常会问道:文章用了哪 2020-05-13 …
(1)不同温度下水的离子积常数如表所示:t/℃01020254050100Kw/10-140.11 2020-06-13 …
化学平衡常数为什么与投料无关?化学平衡常数只和温度有关,但是化学计量数也影响化学平衡常数,如2CO 2020-06-24 …
甲溢水杯盛满密度为r1的液体,乙溢水杯盛满密度为r2的液体。将密度为r的小球轻轻放入甲溢水杯,小球 2020-07-05 …
硫酸工业用SO2制取SO3的反应为2SO2(g)+O2(g)催化剂△2SO3(g)△H=-47kJ 2020-07-09 …
(2012•普陀区一模)经测定某气体在0℃常压下的密度是1.25g/L,查阅数据获得常见气体密度如 2020-07-19 …
一个不规则的扇形面积谁能给我解决,外弧长16.45;内弧长18.4;R110.35;R214.15 2020-08-02 …
水的电离的水的量浓度如何推算?水的电离的离子积常数等于电离常数乘以水的物质的量浓度,计算时物质的量浓 2020-12-28 …