室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是()A.三种酸的电离常数关系:KHA>KHB>KHDB.滴定至P点
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )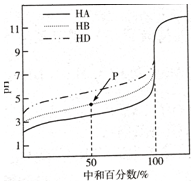
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)
B.中和50%即P点,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),且酸的电离程度大于酸根离子水解程度,
①NaB完全电离:NaB=Na++B-,这一步的c(B-)=c(Na+),
②HB少部分电离:HB⇌H++B-,则c(HB)>c(H+),
③NaB少部分水 B-+H2O⇌HB+OH-,
由于酸的电离程度大于盐的水解程度,则HB电离产生的B-相对NaB水解消耗的B-多,所以c(B-)>c(Na+),由于HB电离消耗得多,水解生成的HB少,
所以c(Na+)>c(HB),则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C.当pH=7时,根据电荷守恒三种溶液中离子浓度关系为:
c(Na+)+c(H+)=c(A-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(A-),
c(Na+)+c(H+)=c(B-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(B-),
c(Na+)+c(H+)=c(D-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(D-),
由于三种酸根的水解程度不同,则溶液呈中性时所消耗的氢氧化钠的体积不相同,则三种溶液中钠离子浓度不同,c(A-)、c(B-)、c(D-)也不同,故C错误;
D.恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的浓度相同,混合后溶液因盐的水解呈碱性,质子守恒的关系为:c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),故D错误;
故选:A.
观察式子的规律:vo=v三,vo+三o=o三,vo+三o+oo=6三,vo+三o+oo+4o=v0 2020-05-13 …
平面解析几何与行列式答好追加50分!已知平面上三点的平面坐标,求三点构成的三角形的面积.注:用行列 2020-06-03 …
一只蚂蚁在一个半圆形的花坛的周边寻找食物,如图1,蚂蚁从圆心O出发,按图中箭头所示的方向,依次匀速 2020-06-17 …
(她0w3•天津模拟)有机物A由C、H、O三种元素组成,其蒸气密度是同温同压下氢气密度v她3倍,核磁 2020-10-31 …
下列各项中字音不正确的一项是:()A.询(xún)问昭(zhāo)示沼(zhǎo)泽B.召(zhāo 2020-11-07 …
下列各项中划线字音不正确的一项是:A.询(xún)问昭(zhāo)示沼(zhǎo)泽B.召(zhāo 2020-11-07 …
如图所示,在△ABC中,D、E分别是AC,AB上的一点,BD与CE交于点O.给出下列三个条件:1.∠ 2020-12-05 …
●数学●点O是△ABC内的一点,且存在λ1,λ2,λ3,使得λ1→OA+λ2→OB+λ3→OC=→0 2020-12-14 …
读下列三幅示意图,简述大陆漂移学说的主要内容。在两亿年前,;后来,;逐渐形成了今天 2020-12-21 …
三角形摆放.o(∩∩)o哈哈如图,用棋子摆成下列三角形.第一个:上面1颗,下面2颗,共3颗;第二个: 2020-12-30 …