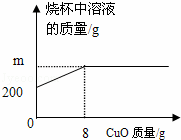
已知烧杯中装有200g硫酸和硫酸铜混合溶液,其中含硫酸铜4.8g.向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.当恰好完全反应时,所得的溶液
已知烧杯中装有 200g 硫酸和硫酸铜混合溶液,其中含硫酸铜 4.8g .向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.
(提示: CuO+H 2 SO 4 =CuSO 4 +H 2 O )请计算:
( 1 ) m= g .
( 2 )原混合溶液中 H 2 SO 4 的质量分数.
( 3 )若取恰好完全反应时所得溶液 10g 配制成 20% 的硫酸铜溶液,需要 30% 的硫酸铜溶液多少克?
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算. .
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
( 1 )由图示可知氧化铜为 8g ,根据方程式可知氧化铜质量全部进入溶液;
( 2 )根据氧化铜的质量和方程式计算硫酸的质量,进一步计算原混合溶液中 H 2 SO 4 的质量分数;
( 3 )根据溶液稀释或浓缩前后溶质的质量不变分析.
( 1 )根据方程式 CuO+H 2 SO 4 =CuSO 4 +H 2 O 可知氧化铜质量全部进入溶液,所以 m=200g+8g=208g
( 2 )设混合溶液中 H 2 SO 4 的质量为 x ,生成硫酸铜的质量为 y
CuO+H 2 SO 4 =CuSO 4 +H 2 O
80 98 160
8g x y
![]() =
= ![]() =
= ![]()
x=9.8g y=16g
原混合溶液中 H 2 SO 4 的质量分数 ![]() ×100%=4.9%
×100%=4.9%
( 3 )恰好完全反应时所得溶液溶质质量分数为 ![]() ×100%=10%
×100%=10%
设需要 30% 的硫酸铜溶液 z
10g×10%+z×30%= ( 10g+z ) ×20%
z=10g
答:( 1 ) 208g
( 2 )原混合溶液中 H 2 SO 4 的质量分数 4.9%
( 3 )需要 30% 的硫酸铜溶液 10g
点评:
本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过 2020-04-08 …
超氧化钾与水反应(2O2-+2H2O=H2O2+O2↑+2OH-)是氧化还原反应吗?有的说不是,其 2020-04-08 …
臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,同时产生O2,则:(1)该反应的化学方程式为:;(2) 2020-04-09 …
已知氧化铜在高温下可发生分解反应4CuO=2Cu2O+O2↑,生成的Cu2O也能被氢气还原成铜,若 2020-04-26 …
用NA表示阿伏伽德罗常数,下列叙述正确的是()A.1molCu和足量热浓硫酸反应可生成NA个SO3 2020-05-13 …
25、将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表: 2020-05-17 …
甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:甲烷3.2克、0克,氧气11.2克、 2020-05-17 …
过氧化钠和二氧化碳反应.反应中转移1mol电子被氧化的过氧化钠的物质的量不也是1mol吗?为什么老 2020-05-17 …
Cu2s与稀硝酸反应方程式为3Cu2s+22HNO3=6Cu(NO3)2+3H2SO4+10NOx 2020-05-21 …
有关氧化还原反应的题0.1mol铁粉和含有0.1molFe(so4)3的溶液混合后充分反应,下列说 2020-05-24 …