早教吧作业答案频道 -->化学-->
某实验小组向100mLFeI2溶液中逐渐通入Cl2,会依次发生如下反应:①Cl2+2I-═2Cl-+I2②Cl2+2Fe2+═2Cl-+2Fe3+③5Cl2+I2+6H2O═10Cl-+2IO3-+12H+其中Fe3+,I2的物质的量随n(Cl2)的变化如图所示.请回答下列问
题目详情
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
①Cl2+2I-═2Cl-+I2
②Cl2+2Fe2+═2Cl-+2Fe3+
③5Cl2+I2+6H2O═10Cl-+2IO3-+12H+
其中Fe3+,I2的物质的量随n(Cl2)的变化如图所示.
请回答下列问题:
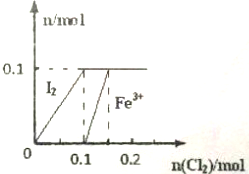
(1)当n(Cl2)=0.13mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子,以及其物质的量___(写出必要的计算过程,否则不得分).
(2)当溶液中n(Cl-):n(IO3-)=10:1时,通入的Cl2在标准状况下的体积为___L(写出必要的计算过程,否则不得分)
①Cl2+2I-═2Cl-+I2
②Cl2+2Fe2+═2Cl-+2Fe3+
③5Cl2+I2+6H2O═10Cl-+2IO3-+12H+
其中Fe3+,I2的物质的量随n(Cl2)的变化如图所示.
请回答下列问题:

(1)当n(Cl2)=0.13mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子,以及其物质的量___(写出必要的计算过程,否则不得分).
(2)当溶液中n(Cl-):n(IO3-)=10:1时,通入的Cl2在标准状况下的体积为___L(写出必要的计算过程,否则不得分)
▼优质解答
答案和解析
(1)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol,
剩余的0.03molCl2与Fe2+反应生成Fe3+,由Cl2+2Fe2+═2Cl-+2Fe3+可知0.03molCl2消耗0.06molFe2+,生成0.06molFe3+,则溶液中剩余0.04molFe2+,
故答案为:0.04molFe2+,0.06molFe3+;
(2)当溶液中n(Cl-):n(IO3-)=10:1时,碘离子转化为碘酸根离子时,Fe2+全部被氧化为Fe3+,由(1)可知碘化亚铁的物质的量是0.1mol,
设碘酸根的物质的量是x,则氯离子的物质的量是10x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=10x×1,x=0.06,所以溶液中碘酸根的物质的量是0.06mol,氯离子的物质的量是0.6mol,根据Cl2~2Cl-知,氯气的物质的量是0.3mol,氯气的体积=0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
剩余的0.03molCl2与Fe2+反应生成Fe3+,由Cl2+2Fe2+═2Cl-+2Fe3+可知0.03molCl2消耗0.06molFe2+,生成0.06molFe3+,则溶液中剩余0.04molFe2+,
故答案为:0.04molFe2+,0.06molFe3+;
(2)当溶液中n(Cl-):n(IO3-)=10:1时,碘离子转化为碘酸根离子时,Fe2+全部被氧化为Fe3+,由(1)可知碘化亚铁的物质的量是0.1mol,
设碘酸根的物质的量是x,则氯离子的物质的量是10x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=10x×1,x=0.06,所以溶液中碘酸根的物质的量是0.06mol,氯离子的物质的量是0.6mol,根据Cl2~2Cl-知,氯气的物质的量是0.3mol,氯气的体积=0.3mol×22.4L/mol=6.72L,
故答案为:6.72.
看了 某实验小组向100mLFeI...的网友还看了以下:
用离子方程式表示下列反应.(1)Cl2通入NaHCO3水溶液中(2)向Fe(NO3)2滴入几滴稀硫 2020-04-12 …
下列各组物质在常见的相互反应中,因条件不同可以得到不同的产物的是①Na和O2②Mg与CO2③NaA 2020-04-25 …
50molKI溶液通入足量的CL2(氯气),反应后蒸发溶液,灼烧固体,最后剩余固体7.45g.试计 2020-04-26 …
一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中 2020-05-15 …
少量Cl2通入FeBr2溶液过量Cl2通入FeBr2溶液Cl2与FeBr2按物质的量4:3反应过量 2020-05-16 …
在标准状况下,将等体积的Cl2和SO2同时通入水中制得某溶液,向该溶液中加入足量的NaHCO3固体 2020-05-17 …
已知2Fe2++Br2=2Fe3++2Br2-,在标准状况下,向100ml0.2mol/L的FeB 2020-05-17 …
在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,既可得到较纯净的F 2020-05-17 …
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值 2020-05-17 …
将一定质量的KMnO4晶体投入到100mlHCl溶液中,恰好完全反映,若生产的Cl2在标准状况下的 2020-06-07 …