早教吧作业答案频道 -->化学-->
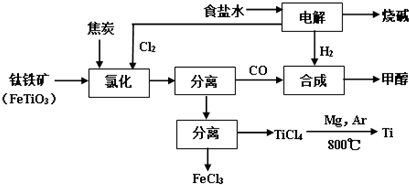
将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品.已知:合成甲醇的主反应为:CO+2H2⇌CH3OH+Q(Q>0,下同);同时有副反应如:8CO+17H2⇌C8H18+8
题目详情
将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品.
已知:合成甲醇的主反应为:CO+2H2⇌CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2⇌C8H18+8H2O+Q
4CO+8H2⇌C4H9OH+3H2O+Q.
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是___(填写化学式).
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式___.
(3)诸如上述联合生产,其优点有___.生产中除了获得上述目标产品外,还能得到副产品___(填写化学式).
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2___吨(不考虑生产过程中物质的损失及副反应).
(5)上述产业链中“氯化”在600℃以上的反应器内进行.已知:
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:___.

已知:合成甲醇的主反应为:CO+2H2⇌CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2⇌C8H18+8H2O+Q
4CO+8H2⇌C4H9OH+3H2O+Q.
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是___(填写化学式).
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式___.
(3)诸如上述联合生产,其优点有___.生产中除了获得上述目标产品外,还能得到副产品___(填写化学式).
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2___吨(不考虑生产过程中物质的损失及副反应).
(5)上述产业链中“氯化”在600℃以上的反应器内进行.已知:
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
▼优质解答
答案和解析
(1)加入氢氧化钠除去镁离子,生成氢氧化镁,再加入氯化钡除去硫酸根离子,生成硫酸钡沉淀,然后加入碳酸钠除去钡离子和钙离子,生成碳酸钡和碳酸钙,故答案为:BaSO4、CaCO3、BaCO3、Mg(OH)2;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO,故答案为:2FeTiO3+6C+7Cl2
2TiCl4+2FeCl3+6CO;
(3)氯碱工业中的产物高效利用,大大提高资源利用率,降低生产成本,有毒气体一氧化碳的利用,减少了环境污染,合成甲醇的主反应为:CO+2H2⇌CH3OH+Q;
同时有副反应如:8CO+17H2⇌C8H18+8H2O+Q;4CO+8H2⇌C4H9OH+3H2O+Q,所以还能得到副产品是C8H18、C4H9OH、FeCl3、MgCl2,故答案为:大大提高资源利用率;降低生产成本;减少环境污染等;C8H18、C4H9OH、FeCl3、MgCl2;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
Cl2~
H2,所以生产1 molCH3OH,理论上还需补充氢气(2-
))mol=
mol,即
gH2,故生产192 t CH3OH还需补充H2的质量10t,故答案为:10;
(5)应用两种氯化物有沸点不同,应用蒸馏的方法分离,具体操作将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分,故答案为:将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分.
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
| ||
| ||
(3)氯碱工业中的产物高效利用,大大提高资源利用率,降低生产成本,有毒气体一氧化碳的利用,减少了环境污染,合成甲醇的主反应为:CO+2H2⇌CH3OH+Q;
同时有副反应如:8CO+17H2⇌C8H18+8H2O+Q;4CO+8H2⇌C4H9OH+3H2O+Q,所以还能得到副产品是C8H18、C4H9OH、FeCl3、MgCl2,故答案为:大大提高资源利用率;降低生产成本;减少环境污染等;C8H18、C4H9OH、FeCl3、MgCl2;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
| 7 |
| 6 |
| 7 |
| 6 |
| 7 |
| 6 |
| 5 |
| 6 |
| 5 |
| 3 |
(5)应用两种氯化物有沸点不同,应用蒸馏的方法分离,具体操作将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分,故答案为:将氯化后的混合物冷却至1360C以下,使TiCl4和FeCl3均为液体;加热蒸馏混合液体,收集1360C的馏分.
看了 将炼钛厂、氯碱厂和甲醇厂组成...的网友还看了以下:
为什么电解水时,在水中加强碱就会使点解速度加快?电解时,是H+和OH-得失电子.加入强碱后,水中的H 2020-03-30 …
20℃时,碳酸氢钠的溶解度为9.7g,其含义是在20℃时,;工业上用氨碱法制纯碱时,向饱和氨盐水中 2020-05-17 …
甲、乙两人从A地出发,同时同向而行,乙以5km/h的速度步行,较甲先出发2小时.如果甲骑车要在半小 2020-05-22 …
..以及解析...一,溶液浓度的表示方法和配制(配制比例浓度,配制质量百分比浓度,配制题记百分比浓 2020-06-05 …
水溶液的酸碱性与[H+]和[OH-]的相对大小关系[H+]=[OH-]溶液呈性[H+]>[OH-] 2020-06-22 …
你接触过纯碱吗?小明同学用湿润的手触摸厨房里的纯碱时,有滑腻感;用pH试纸测试纯碱水溶液的酸碱性, 2020-07-14 …
数学题来简答啊某运动员在一条公路上进行骑摩托车训练,平均速度为90KM|H.出发时有一辆公共汽车和该 2020-11-14 …
(2005•山东)你接触过纯碱吗?小明同学用湿润的手触摸厨房里的纯碱时,感觉有滑腻感,他好奇地用pH 2020-11-15 …
你接触过纯碱吗?小明同学用湿润的手触摸厨房里的纯碱时,有滑腻感;用pH试纸测试纯碱水溶液的酸碱性,发 2020-11-15 …
氯碱厂电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:根据题意完成下列填空:(1)电解过程中发生� 2020-12-01 …