早教吧作业答案频道 -->化学-->
利用镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)中含有的碳作还原剂,进行选择性还原熔炼,可以提取镍铁合金,同时得到钼酸钠晶体(Na2MoO4•2H2O),其主要流程如图:(1)选择性还
题目详情
利用镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)中含有的碳作还原剂,进行选择性还原熔炼,可以提取镍铁合金,同时得到钼酸钠晶体(Na2MoO4•2H2O),其主要流程如图:
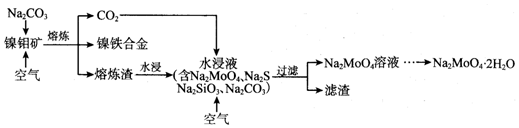
(1)选择性还原熔炼的优点之一是将S元素转化为Na2S,避免了污染性气体SO2的产生.检验炉气中是否含有SO2的方法为___
(2)还原熔炼时,FeS2发生的反应为3FeS2+6Na2CO3+11C+8O2
3Fe+6Na2S+17CO2,该反应中氧化产物是,反应每转移11mol e-,生成铁的质量为___g.
(3)水浸液中通入适量CO2和空气,然后过滤,所得滤渣的主要成分为___.
(4)知钼酸钠溶液中c(MoO42-)=0.4 0mol•L-1,c(CO32-)=0.10mol•L-1.由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-.当BaMoO4开始沉淀时,CO32-的去除率是___[己知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
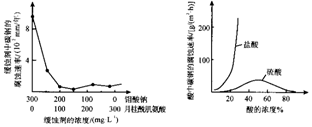
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应___
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___
③随着盐酸和硫酸浓度的增大,碳素钢在盐酸中的腐蚀速率明显加快,其原因可能是,请设计实验证明上述结论:___.

(1)选择性还原熔炼的优点之一是将S元素转化为Na2S,避免了污染性气体SO2的产生.检验炉气中是否含有SO2的方法为___
(2)还原熔炼时,FeS2发生的反应为3FeS2+6Na2CO3+11C+8O2
| ||
(3)水浸液中通入适量CO2和空气,然后过滤,所得滤渣的主要成分为___.
(4)知钼酸钠溶液中c(MoO42-)=0.4 0mol•L-1,c(CO32-)=0.10mol•L-1.由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-.当BaMoO4开始沉淀时,CO32-的去除率是___[己知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应___
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___
③随着盐酸和硫酸浓度的增大,碳素钢在盐酸中的腐蚀速率明显加快,其原因可能是,请设计实验证明上述结论:___.
▼优质解答
答案和解析
(1)用品红溶液检验二氧化硫,具体检验二氧化硫存在的方法为:将炉气通入品红中,若品红褪色,加热后又恢复红色,证明炉气中有SO2,若品红不褪色,择炉气中不含有SO2,
故答案为:将炉气通入品红中,若品红褪色,加热后又恢复红色,证明炉气中有SO2,若品红不褪色,择炉气中不含有SO2;
(2)3FeS2+6Na2CO3+11C+8O2
3Fe+6Na2S+17CO2,反应中化合价升高的元素为C元素化合价由0价升高为+4价,(11C→11CO2),化合价降低的元素为Fe、S、O元素,
Fe由+2价降低为0价,((3FeS2→3Fe),S由-1价降低为-2价,((3FeS2→6Na2S)0由0价降低为-2价,(8O2→17CO2),C元素化合价由0价升高为+4价,故CO2是氧化产物;反应中只有C元素化合价升高,每消耗11mol C时转移电子为44mol,生成铁3mol,反应每转移11mol e-,生成铁
mol,生成铁的质量为
mol×56g/mol=42g,
故答案为:CO2;42g;
(3)SiO2是酸性氧化物,能与碱性溶液反应,水浸液中含SiO32-,通入二氧化碳后发生反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故所得到的沉淀为H2SiO3,
故答案为:H2SiO3;
(4)Ksp(BaMoO4)=4.0×10-8,钼酸钠溶液中c(MoO42-)=0.4 0mol•L-1,BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
=1×10-7mol/L,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子的浓度为:c(CO32-)=
mol/L=1.0×10-2mol/L,原溶液中c(CO32-)=0.10mol•L-1,碳酸根离子的去除率为:1-
×100%=1-10%≈90%,
故答案为:90%;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,
故答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,设计实验证明上述结论可设计为:向上述硫酸溶液中加入少量氯化钠等可溶性氯化物,碳素钢的腐蚀速率明显加快,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀;向上述硫酸溶液中加入少量氯化钠等可溶性氯化物,碳素钢的腐蚀速率明显加快.
故答案为:将炉气通入品红中,若品红褪色,加热后又恢复红色,证明炉气中有SO2,若品红不褪色,择炉气中不含有SO2;
(2)3FeS2+6Na2CO3+11C+8O2
| ||
Fe由+2价降低为0价,((3FeS2→3Fe),S由-1价降低为-2价,((3FeS2→6Na2S)0由0价降低为-2价,(8O2→17CO2),C元素化合价由0价升高为+4价,故CO2是氧化产物;反应中只有C元素化合价升高,每消耗11mol C时转移电子为44mol,生成铁3mol,反应每转移11mol e-,生成铁
| 3 |
| 4 |
| 3 |
| 4 |
故答案为:CO2;42g;
(3)SiO2是酸性氧化物,能与碱性溶液反应,水浸液中含SiO32-,通入二氧化碳后发生反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故所得到的沉淀为H2SiO3,
故答案为:H2SiO3;
(4)Ksp(BaMoO4)=4.0×10-8,钼酸钠溶液中c(MoO42-)=0.4 0mol•L-1,BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
| 4.0×10-8 |
| 0.4mol/L |
| 1.0×10-9 |
| 1..0×10-7 |
| 1.0×10-2 |
| 0.1 |
故答案为:90%;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,
故答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,设计实验证明上述结论可设计为:向上述硫酸溶液中加入少量氯化钠等可溶性氯化物,碳素钢的腐蚀速率明显加快,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀;向上述硫酸溶液中加入少量氯化钠等可溶性氯化物,碳素钢的腐蚀速率明显加快.
看了 利用镍钼矿(主要含有MoS2...的网友还看了以下:
乙烯能否与过氧化氢发生加成反应?H-O-O-H+CH2=CH2==H-O-CH2-CH2-O-H 2020-05-16 …
窈窕淑女,君子好逑中的好是读hǎo还是hào呢窈窕淑女,君子好逑中的好是读hǎo还是hào原来一直 2020-05-22 …
下列有关糖类和脂肪的元素组成的叙述中,正确的是()A.糖类只含C、H、O,而脂肪除含C、H、O三种 2020-06-25 …
您好,请问您知道以下内容出自那篇文章吗?水分子结构中的O—H键长和H—O—H键角的科学研究并未得到 2020-07-17 …
进制换算(213)D=()B=()H=()O(69.625)D=()D=()B=()O(127)D 2020-07-19 …
若某共价化合物分子中只含有C、H、O、N四种元素,且以n(C)、n(N)、n(O)分别表示C、N、 2020-07-20 …
若某共价化合物中含有C、H、O、N四种元素,且以n(C)、n(N)、n(O)分别表示C、N、O的原 2020-07-21 …
组成家兔身体的主要元素是:A选项(C、H、O、N、Fe、P)B选项(H、O、K、S、P、Mg)C选项 2020-11-14 …
某有机物由C,H,O三种元素组成,它的红外吸收光谱表明有羟基中O—H键和烃基中C—H键的红外某有机物 2020-11-25 …
化学科学需要借助化学专用语言来描述,下列化学用语的书写不正确的是()A.过氧化氢结构式:H-O-O- 2020-12-22 …