早教吧作业答案频道 -->化学-->
FeCl2是一种常用的还原剂.有关数据如下:实验室可以用多种方法来制备无水FeCl2.回答下列问题:I.按如图1装置用H2还原无水FeCl3制取.(1)用装置A制取H2,其优点是;D中反应的化学方
题目详情
FeCl2是一种常用的还原剂.有关数据如下:
实验室可以用多种方法来制备无水FeCl2.回答下列问题:
I.按如图1装置用H2还原无水FeCl3制取.
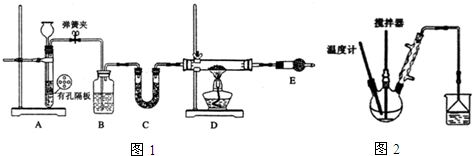
(1)用装置A制取H2,其优点是___;D中反应的化学方程式为___;装置E的作用是___.
(2)通人足量H2,充分反应.如果温度控制不当,产品中会含单质铁.检验产品中是否 含铁的方案是___.
Ⅱ.按图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是___.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5C1并不会大量损失.原因是___.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是___;
②简述回收滤液中C6H5C1的方案___.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达 到或超过90%,则烧杯中加入的试剂可以是___.
实验室可以用多种方法来制备无水FeCl2.回答下列问题:
I.按如图1装置用H2还原无水FeCl3制取.

(1)用装置A制取H2,其优点是___;D中反应的化学方程式为___;装置E的作用是___.
(2)通人足量H2,充分反应.如果温度控制不当,产品中会含单质铁.检验产品中是否 含铁的方案是___.
Ⅱ.按图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是___.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5C1并不会大量损失.原因是___.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是___;
②简述回收滤液中C6H5C1的方案___.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达 到或超过90%,则烧杯中加入的试剂可以是___.
▼优质解答
答案和解析
I.按如图1装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化氯生成氯化亚.
(1)装置A为启普发生器的简易装置,适用于固液混合状态且不需加热而制取的气体,且固体必须是块状的,该装置的优点是便于控制反应,实验室一般用锌和稀盐酸制备H2,用装置A制取H2,通过开关弹簧夹,可以使反应随时进行或停止,根据上面的分析可知,E中盛放的试剂是碱石灰;吸收氯化氢气体,同时防止空气中的水份进入D装置,D中反应的化学方程式为H2+2FeCl3
2FeCl2+2HCl,
故答案为:通过开关弹簧夹,可以使反应随时进行或停止;H2+2FeCl3
2FeCl2+2HCl;吸收氯化氢气体同时防止空气中的水份进入D装置;
(2)温度控制不当,产品中含单质铁.检验产品中是否含铁的方案为取样,加入盐酸中,观察是否有气泡产生,
故答案为:取样品少许放入试管中,向其中加入盐酸,观察是否有气泡产生;
II.(3)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂,
故答案为:C6H5Cl;
(4)根据图2可知,装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,
故答案为:实验使用了冷凝回流装置;
(5)三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知,可以用有机溶剂例如苯将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,
①洗涤所用的试剂可以是苯;
故答案为:苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分,
故答案为:蒸馏滤液,并收集132℃馏分;
(6)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl,氯化铁转化率达到或超过90%,则可产生氯化氢的物质的量为
×
=0.45mol,所以可在烧杯中加入0.45×40g的氢氧化钠即18g,并用酚酞作指示剂进行判断反应进行的程度,如果18g氢氧化钠完全反应,则产率达到或超过90%,
故答案为:滴有酚酞且含18g NaOH的溶液.
(1)装置A为启普发生器的简易装置,适用于固液混合状态且不需加热而制取的气体,且固体必须是块状的,该装置的优点是便于控制反应,实验室一般用锌和稀盐酸制备H2,用装置A制取H2,通过开关弹簧夹,可以使反应随时进行或停止,根据上面的分析可知,E中盛放的试剂是碱石灰;吸收氯化氢气体,同时防止空气中的水份进入D装置,D中反应的化学方程式为H2+2FeCl3
| ||
故答案为:通过开关弹簧夹,可以使反应随时进行或停止;H2+2FeCl3
| ||
(2)温度控制不当,产品中含单质铁.检验产品中是否含铁的方案为取样,加入盐酸中,观察是否有气泡产生,
故答案为:取样品少许放入试管中,向其中加入盐酸,观察是否有气泡产生;
II.(3)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知,氯苯能使氯化铁生成氯化亚铁,所以氯苯为还原剂,
故答案为:C6H5Cl;
(4)根据图2可知,装置有冷凝回流装置,所以为了提高反应速率,可以将反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,
故答案为:实验使用了冷凝回流装置;
(5)三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2,根据其溶解性可知,可以用有机溶剂例如苯将C6H5Cl、C6H4Cl2溶解,过滤后可得氯化亚铁,对滤液进行蒸馏可回收C6H5Cl,
①洗涤所用的试剂可以是苯;
故答案为:苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分,
故答案为:蒸馏滤液,并收集132℃馏分;
(6)根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl,氯化铁转化率达到或超过90%,则可产生氯化氢的物质的量为
| 162.5g |
| 162.5g/mol |
| 1 |
| 2 |
故答案为:滴有酚酞且含18g NaOH的溶液.
看了 FeCl2是一种常用的还原剂...的网友还看了以下:
下列有关氧气的性质或用途正确的是()A.标准状况下密度比空气小B.易溶于水C.可以供给呼吸D.可以 2020-04-11 …
洗涤剂能洗去餐具上的油污是因为洗涤剂()A.有乳化功能B.可溶解于水C.可以溶解油污D.可以稀释油 2020-05-13 …
造成污水管顶部腐蚀的原因通常是()。A.碱性工业废水B.酸性工业废水C.可燃性气体D.硫化氢气体 2020-05-28 …
常用的软胶囊囊壳的组成为()A.明胶、甘油、水B.淀粉、甘油、水C.可压性淀粉、丙二醇、水D.明胶、 2020-05-31 …
下列现象不可能存在的是A烫手的冰B不烫手的开水C可燃烧的"可燃冰"D干冰在常温下先熔化在汽化 2020-06-20 …
下列物质中按混合物、氧化物、单质的顺序排列的是()A.冰水混合物、水银、食醋B.清新的空气、氖气、 2020-07-22 …
下面是某同学对所给题目的解答过程,找出该同学解题中存在的错误,并加以改正.在标准大气压下,2kg初温 2020-11-05 …
在蜡烛火焰上方罩一只干燥的烧杯,烧杯内壁有水雾出现,证明了()A.蜡烛中含有水B.蜡烛燃烧时生成了水 2020-11-16 …
洗涤剂能洗去餐具上的油污是因为洗涤剂()A.有乳化功能B.可溶解于水C.可以溶解油污D.可以稀释油污 2020-12-02 …
一个实心球是有密度分别为ρ1、ρ/2的两个半球组成的(ρ1≠ρ2),若把此合金球投入水中,发现刚好悬 2020-12-14 …