早教吧作业答案频道 -->化学-->
钴是重要的战略金属元素,钴及其化合物在化工、机械、航空和军事等部门具有广泛的应用.以水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等杂质)制取CoC2O4的工艺流程如图1:
题目详情
钴是重要的战略金属元素,钴及其化合物在化工、机械、航空和军事等部门具有广泛的应用.以水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等杂质)制取CoC2O4的工艺流程如图1:
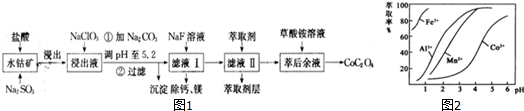
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)浸出过程中加入Na2SO3的目的是将___(填离子符号)还原.
(2)向浸出液中加入NaClO3的作用是将Fe2+氧化成Fe3+,反应的离子方程式为___.
(3)浸出液中加Na2CO3调pH至5.2时生成的沉淀为___(填化学式),能够生成此沉淀的原因是___(用离子方程式结合必要的文字说明).
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.
已知Ksp( MgF2)=7.35×10-ll、Ksp( CaF2)=1.05×10-10,当加入过量NaF后,所得滤液中
=___
(5)滤液Ⅱ中加入萃取剂的作用是___,萃取剂对金属离子的萃取率与pH的关系如图2所示.使用萃取剂适宜的pH是___(填字母).
a.接近2.0
b.接近3.0
c.接近4.0.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将___(填离子符号)还原.
(2)向浸出液中加入NaClO3的作用是将Fe2+氧化成Fe3+,反应的离子方程式为___.
(3)浸出液中加Na2CO3调pH至5.2时生成的沉淀为___(填化学式),能够生成此沉淀的原因是___(用离子方程式结合必要的文字说明).
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.
已知Ksp( MgF2)=7.35×10-ll、Ksp( CaF2)=1.05×10-10,当加入过量NaF后,所得滤液中
| c(Mg2+) |
| c(Ca2+) |
(5)滤液Ⅱ中加入萃取剂的作用是___,萃取剂对金属离子的萃取率与pH的关系如图2所示.使用萃取剂适宜的pH是___(填字母).
a.接近2.0
b.接近3.0
c.接近4.0.
▼优质解答
答案和解析
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,
故答案为:Fe3+、Co3+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)铁离子和铝离子都能水解,Fe3++3H2O⇌Fe(OH)3+3H+,Al3++3H2O⇌Al(OH)3+3H+,加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀,
故答案为:Fe(OH)3、Al(OH)3; 铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2、2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀;
(4)当加入过量NaF后,所得滤液
=
=
=
=0.7,
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去Mn2+;b.
故答案为:Fe3+、Co3+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)铁离子和铝离子都能水解,Fe3++3H2O⇌Fe(OH)3+3H+,Al3++3H2O⇌Al(OH)3+3H+,加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀,
故答案为:Fe(OH)3、Al(OH)3; 铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2、2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,从而产生沉淀;
(4)当加入过量NaF后,所得滤液
| C(Mg2+) |
| C(Ca2+) |
| ||
|
| KSP(MgF2) |
| KSP(CaF2) |
| 7.35×10-11 |
| 1.05×10-10 |
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去Mn2+;b.
看了 钴是重要的战略金属元素,钴及...的网友还看了以下:
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”.(1)电解食盐水的反应方程式为o她aCl+ 2020-05-14 …
请问你回答的“工业怎样合成苯甲酸”这个问题,用法是:甲苯液相空气氧化生产苯甲酸.条件:液相空气氧化 2020-05-17 …
合作的二元一次方程某市为缓解缺水,要把2OO千米以外的大河引到城市中,工期为5O天,甲乙合作了3O 2020-05-17 …
某工程挖土深度为O.4m,坑底宽2.8m,长l0m,则该土方工程应按()计算工程量。A.平整场地B. 2020-05-19 …
如图,AB为圆O的直径,PB为O的切线,AC//OP,点C在圆O上,OP交圆O于D,DA交BC于G 2020-06-27 …
如图是俄罗斯主要工业区示意图,下列关于俄罗斯工业区的叙述正确的是()A.O为圣彼得堡为中心的工业区 2020-07-01 …
某检修小组乘汽车沿公路检修线路,约定前进为正,后退为负,某天自O地出发时所走路线(单位:千米)为: 2020-07-26 …
某检修小组乘汽车沿公路检修线路,约定前进为正,后退为负,某天自0地出发到收工时所走路线(单位:千米 2020-07-26 …
(2002•鄂州)如图,挂着“庆祝凤凰广场竣工”条幅的氢气球升在广场上空,已知气球的直径为4m,在 2020-08-04 …
制氢氧化钴为什么不用3价钴离子直接加碱制取 2020-11-01 …