早教吧作业答案频道 -->化学-->
磺酰氯(SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)⇌SO2Cl2(g)△H=-97.3kJ•mol-1(1)SO2Cl2中S的化合价是.(2)恒温时,将SO2与Cl2各0
题目详情
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)⇌SO2Cl2(g)△H=-97.3kJ•mol-1
(1)SO2Cl2中S的化合价是___.
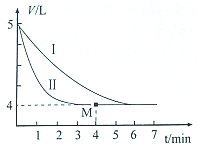
(2)恒温时,将SO2与Cl2各0.l mol充入体积可变的密闭容器中发生上述反应,容器体积变化如图曲线I所示.
①平衡时c( SO2Cl2)=___.
②仅改变某一条件,就能使容器体积变化为曲线II,这个条件是___,当反应至M点时放出的热量为___.
③___(填“能”、“不能”)仅改变某一条件,使平衡常数K和反应速率v(正)都增大,理由是___.
(3)测定磺酰氯纯度:称取0.3000g磺酰氯试样溶于28.00mL l.000mol/L NaOH溶液中,充分反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL.(杂质不参加反应)
①磺酰氯能发生剧烈水解反应生成两种强酸,化学方程式为___.
②该试样纯度为___.
(4)Li-SO2Cl2新型电池的总反应为2Li+SO2Cl2═2LiCl+SO2,则正极反应为___.

(1)SO2Cl2中S的化合价是___.
(2)恒温时,将SO2与Cl2各0.l mol充入体积可变的密闭容器中发生上述反应,容器体积变化如图曲线I所示.
①平衡时c( SO2Cl2)=___.
②仅改变某一条件,就能使容器体积变化为曲线II,这个条件是___,当反应至M点时放出的热量为___.
③___(填“能”、“不能”)仅改变某一条件,使平衡常数K和反应速率v(正)都增大,理由是___.
(3)测定磺酰氯纯度:称取0.3000g磺酰氯试样溶于28.00mL l.000mol/L NaOH溶液中,充分反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL.(杂质不参加反应)
①磺酰氯能发生剧烈水解反应生成两种强酸,化学方程式为___.
②该试样纯度为___.
(4)Li-SO2Cl2新型电池的总反应为2Li+SO2Cl2═2LiCl+SO2,则正极反应为___.
▼优质解答
答案和解析
(1)SO2Cl2中Cl为-1价,O为-2价,化合物中正负化合价的倒数和为0,则S元素的化合价为0-(-1)×2-(-2)×2=+6,故答案为:+6;
(2)由图可知,5V气体达到平衡时变化为4L,体积之比等于物质的量之比,平衡时物质的量为0.2mol×
=0.16mol,
SO2(g)+Cl2(g)⇌SO2Cl2(g)
开始 0.1 0.1 0
转化 x x x
平衡 0.1-x 0.1-x x
则0.1-x+0.1-x+x=0.16mol,解得x=0.04mol,
①平衡时c( SO2Cl2)=
=0.01mol/L,故答案为:0.01mol/L;
②I与II始终态的量相同,II中反应速率快,改变条件为使用催化剂;物质的量与热量成正比,则当反应至M点时放出的热量为0.04mol×97.3kJ/mol=3.892kJ,
故答案为:使用催化剂;3.892kJ;
③该反应为放热反应,K只与温度有关,则不能仅改变某一条件,使平衡常数K和反应速率v(正)都增大,降低温度时反应速率减小、K增大,
故答案为:不能;正反应为放热反应,要使K增大只能降温,而降低温度反应速率减小;
(3)①SO2Cl2遇水发生剧烈水解,生成HCl和H2SO4,反应方程式为SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL,则中和的NaOH为0.02016L×1.000mol/L=0.02016mol,则中和磺酰氯需要的NaOH为0.028L×l.000mol/L-0.02016mol=0.00784mol,由SO2Cl2+2H2O=H2SO4+2HCl可知n(SO2Cl2)=
=0.00196mol,其质量为0.00196mol×135g/mol=0.2642g,该试样纯度为
×100%=88.20%,故答案为:88.20%;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,可知电极反应式为SO2Cl2+2e-=2Cl-+SO2↑,故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
(2)由图可知,5V气体达到平衡时变化为4L,体积之比等于物质的量之比,平衡时物质的量为0.2mol×
| 4 |
| 5 |
SO2(g)+Cl2(g)⇌SO2Cl2(g)
开始 0.1 0.1 0
转化 x x x
平衡 0.1-x 0.1-x x
则0.1-x+0.1-x+x=0.16mol,解得x=0.04mol,
①平衡时c( SO2Cl2)=
| 0.04mol |
| 4L |
②I与II始终态的量相同,II中反应速率快,改变条件为使用催化剂;物质的量与热量成正比,则当反应至M点时放出的热量为0.04mol×97.3kJ/mol=3.892kJ,
故答案为:使用催化剂;3.892kJ;
③该反应为放热反应,K只与温度有关,则不能仅改变某一条件,使平衡常数K和反应速率v(正)都增大,降低温度时反应速率减小、K增大,
故答案为:不能;正反应为放热反应,要使K增大只能降温,而降低温度反应速率减小;
(3)①SO2Cl2遇水发生剧烈水解,生成HCl和H2SO4,反应方程式为SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②反应后,用1.000mol/L HCl返滴定至终点,耗用盐酸20.16mL,则中和的NaOH为0.02016L×1.000mol/L=0.02016mol,则中和磺酰氯需要的NaOH为0.028L×l.000mol/L-0.02016mol=0.00784mol,由SO2Cl2+2H2O=H2SO4+2HCl可知n(SO2Cl2)=
| 0.00784mol |
| 4 |
| 0.2642g |
| 0.3g |
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,可知电极反应式为SO2Cl2+2e-=2Cl-+SO2↑,故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
看了 磺酰氯(SO2Cl2)是一种...的网友还看了以下:
如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极 2020-05-13 …
一道关于晨线昏线的地理题最近在复习高一必修1地理,发现笔记上有这么一个图.连题干都缺了.请各位帮帮 2020-05-17 …
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红 2020-06-23 …
电解池原理在硫酸铜溶液中进行电解.阳极上的方程式是4OH-4e=O2+2H2O.其中是4个氢氧根参 2020-06-23 …
关于电磁感应一个蹄形磁铁横着放,若是底下为N极,上面为S极.一根闭合回路中的导体朝那些方向才可以产 2020-07-05 …
右图为北极上空俯视图。17.若阴影部分表示黑夜,甲地时间为A.8时B.9时C.15时D.16时18 2020-07-13 …
右图为北极上空俯视图。17.若阴影部分表示黑夜,甲地时间为A.8时B.9时C.15时D.16 2020-07-13 …
选择图为南极上空某节气晨昏线图,图中晨昏线与极圈相切于P点。此时伦敦为星期六,但北京已是星期日。回 2020-07-15 …
把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池.若a、b相连时a溶解 2020-07-25 …
把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、 2020-07-29 …