早教吧作业答案频道 -->化学-->
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g);△H<0.(1)在373K
题目详情
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g);△H<0.
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=___.
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是___.
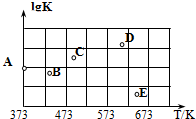
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为___.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为___点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为___kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为___,电解质中锂离子移向___(填“正极”或“负极”).

(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①反应开始至达到平衡时,v(SOCl2)=___.
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是___.
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点.
①A点的数值为___.(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为___点.
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为___kJ.
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为___,电解质中锂离子移向___(填“正极”或“负极”).
▼优质解答
答案和解析
(1)①向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,设参与反应的为SO2为x,则:
SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g)
n始:0.04 0.04 0.04 0
n转:x x x 2x
n平:0.04-x 0.04-x 0.04-x 2x
由表可知,4min达到平衡,温度相同、体积相同,气体的物质的量之比=气体的压强之比,则
=
=
,解得x=0.02mol,则反应开始至达到平衡时,v(SOCl2)=
=0.005mol/(L•min);
故答案为:0.005mol/(L•min);
②II与Ⅰ比较,达到平衡所用时间段,说明反应速率加快,但平衡状态一样,应为使用催化剂;
故答案为:使用催化剂;
(2)①根据(1)可知,373K时:
SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g)
c平:0.01 0.01 0.01 0.02
则化学平衡常数K=
=400,则A点的数值为lgK=lg400=2.6;
故答案为:2.6
②该反应为放热反应,升高温度,K值减小,lgK减小,故A可能变化为B、E两点;
故答案为:BE;
(3)反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,设1molCl2(g)分子中化学键断裂时需吸收的能量为Q,则△H=1064+4×Q-4×510=-4,解得Q=243;
故答案为:243;
(4)正极得电子发生还原反应,结正极电极反应式为:2SOCl2+4e-=S+SO2↑+4Cl-;阳离子移向正极,所以电解质中锂离子移向正极;
故答案为:2SOCl2+4e-=S+SO2↑+4Cl-;正极.
SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g)
n始:0.04 0.04 0.04 0
n转:x x x 2x
n平:0.04-x 0.04-x 0.04-x 2x
由表可知,4min达到平衡,温度相同、体积相同,气体的物质的量之比=气体的压强之比,则
| P平 |
| P始 |
| 0.12-x |
| 0.12 |
| 5.0P0 |
| 6.0P0 |
| 0.02mol×2÷2L |
| 4min |
故答案为:0.005mol/(L•min);
②II与Ⅰ比较,达到平衡所用时间段,说明反应速率加快,但平衡状态一样,应为使用催化剂;
故答案为:使用催化剂;
(2)①根据(1)可知,373K时:
SO2(g)+Cl2(g)+SCl2(g)⇌2SOCl2(g)
c平:0.01 0.01 0.01 0.02
则化学平衡常数K=
| 0.022 |
| 0.013 |
故答案为:2.6
②该反应为放热反应,升高温度,K值减小,lgK减小,故A可能变化为B、E两点;
故答案为:BE;
(3)反应S4(g)+4Cl2(g)═4SCl2(g)的△H=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,设1molCl2(g)分子中化学键断裂时需吸收的能量为Q,则△H=1064+4×Q-4×510=-4,解得Q=243;
故答案为:243;
(4)正极得电子发生还原反应,结正极电极反应式为:2SOCl2+4e-=S+SO2↑+4Cl-;阳离子移向正极,所以电解质中锂离子移向正极;
故答案为:2SOCl2+4e-=S+SO2↑+4Cl-;正极.
看了 氯化亚砜用于医药、农药、染料...的网友还看了以下:
硫及其化合物是重要的化工原料,在工农业生产应用广泛.(1)二氯亚砜(SOCl2)在有机合成工业用做 2020-05-13 …
羧酸与二氯亚砜反应制备酰氯,用的溶剂是二氯亚砜,反应完之后用什么方法能把溶剂尽可能的出尽? 2020-05-16 …
急求三氯化磷,氯乙酰氯,亚磷酸,盐酸的市场调研报告, 2020-05-17 …
有一种新型的锂电池,其制作是利用了金属锂和石墨作电极,其电解质溶液是四氯合铝酸锂(LiAlCl4) 2020-06-14 …
2-(chloromethyl)pyridine氯亚甲基吡啶为什么要做成盐酸盐的形式保存?是因为2 2020-07-14 …
二氯亚砜(SOCl2)是一种无色易挥发液体,熔点-105℃,沸点79℃,140℃以上易分解,遇水剧 2020-07-15 …
氯亚铂酸钾很容易被还原吗?我做了几个实验,结果都出现了一层黑色的铂,有没有人知道原因?或者有什么方 2020-07-16 …
氯铂酸钾和氯亚铂酸钾中的铂分别是几价的? 2020-07-16 …
对氨基苯甲酰氯的重结晶如题,本科毕业论文,我用的是老师教的方法,用对氨基苯甲酸和二氯亚砜,合成出来的 2020-11-21 …
烟酰氯盐酸盐溶解于哪些有机溶剂?用烟酸和二氯亚砜制备时,为什么蒸馏走氯化亚砜后还要用乙醚回流,乙醚回 2020-11-29 …